- Subiecte
- rezumat
- Introducere
- Rezultate
- Alterarea glicopatternului în ser datorită ASD versus TD
- Identificare MBG
- Analiza ontologiei genice a MBG-urilor
- Analiza rețelei KEGG Pathway și Protein Interaction
- Preferința motivului secvenței MBG
- Exprimarea și sialoglicozilarea MBG în probe individuale de ser
- Discuţie
- Materiale și metode
- Aprobarea studiului
- Subiecte
- Colectarea și pregătirea probelor
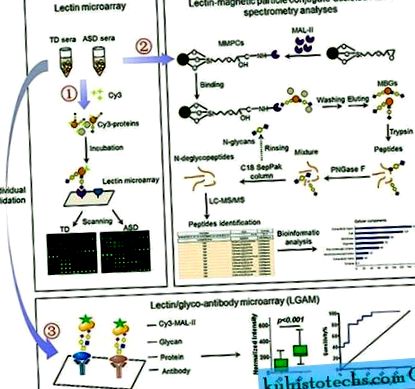
- Lectin Microarray și analiza datelor
- Microarray seric și analiza datelor
- Izolarea și digestia MBG-urilor
- Analiza LC-MS/MS
- Cuantificare relativă fără etichete prin calculul indicelui spectral
- Exploatarea datelor și Bioinformatica
- Lectină/Glyco-Anticorp Microarrays și analiza datelor
- informatii suplimentare
- Informatie suplimentara
- Fișiere PDF
- Informatie suplimentara
- Fișiere Excel
- Tabelele suplimentare
- Comentarii
Subiecte
- Tulburări ale spectrului autist
- Biomarkeri
- Glucomică
rezumat
Instrumentele proteomice permit un mod de examinare automată, la scară largă, bazat pe tehnologie, care oferă posibilitatea de a determina întregul proteom într-un anumit fluid corporal, fără presupuneri prealabile despre moleculele candidate 12. Pe baza acestui fapt, un total de cinci componente peptidice corespunzătoare a patru proteine cunoscute [Apolipoproteina (apo) B-100, Proteina factorului de complement H (FHR1), Complementul C1q și Fibronectina 1 (FN1)] s-au dovedit a fi mai mari pentru autism comparativ cu controalele 13. Trei potențiale vârfuri de biomarkeri au prezentat rapoarte m/z de aproximativ 4,40, 5,15 și 10,38 kDa diferențiat semnificativ eșantionul ASD de grupul de control atunci când au analizat proteine întregi și non-peptide după digestia triptică .
Imagine la dimensiune completă
Rezultate
Alterarea glicopatternului în ser datorită ASD versus TD
Proiectarea microarray-ului de lectină și glicopatternurile rezultate ale glicoproteinelor serice definite de microarrays pentru grupurile ASD și TD sunt prezentate în Fig. 2A, B. Datele originale au fost importate în EXPANDER 6.0 pentru analiza ierarhică a clusterelor (Fig. 2 C) . Intensitățile fluorescente normalizate (NFI) și specificitățile legate de zahăr pentru fiecare dintre cele 37 de lectine din cele două grupuri sunt rezumate în Tabelul S1. Ca rezultat al analizei diferențiale, cinci lectine au arătat diferențe semnificative între grupurile ASD și TD. MAL-II (Siaα2-3 Gal/GalNAc) și MAL-I (Siaα2-3Galβ-1, 4GlcNAc și Galβ-1, 4GlcNAc) au arătat cele mai semnificative creșteri ale NFI (schimbare de ori = 3,33 și 2,20, p
( LA ) Proiectarea microarray-ului de lectină. ( B ) Imagini ale proteinelor serice marcate cu TD și ASD Cy3 legate de microarraysuri de lectină. Imaginile fluorescente au fost scanate cu un tub fotomultiplicator de 70% și setări de putere 100% laser pe un scaner confocal Genepix 40 00B. O porțiune a diapozitivului este prezentată cu trei tablouri de lectină replicate. Lectinele au prezentat diferențe semnificative, marcate cu rame albe. ( C ) Analiza ierarhică a clusterelor NFI pentru cele 37 de lectine TD-1
5. Probele sunt listate în coloane, iar lectinele sunt listate pe rânduri. Culoarea și intensitatea fiecărui pătrat indică niveluri de expresie în raport cu celelalte date din rând. Roșu, înalt; privește jos; negru, mediu. Cadrul galben și albastru a marcat intensitatea de legare a lectinei mai mare și mai mică în serurile ASD versus TD. ( D ) Analiza diferențială a IFN pentru cinci lectine TD-1
( A, B ) Identificarea peptidelor și glicoproteinelor corespunzătoare ale acestora în serurile TD și ASD prin LC-MS/MS. ( C ) Proporția de N-glicoproteine (NY) și O-glicoproteine (OY) cunoscute din baza de date UniProtKB/Swiss-Prot și glicoproteinele prezise cu site-uri potențiale de N-glicozilare (NP) și potențiale situri de O-glicozilare (OP)) ( D ) Analiza căii KEGG a GBM identificată (marcată cu o stea roșie) în complement și cascade de coagulare 60. Săgeată roșie, reglare ascendentă a MBG; săgeată verde, reglare scăzută a GBM în ASD. Analiza rețelei de interacțiune proteică a GBM-urilor identificate (sferă roșie) care au fost reglate în sus (săgeată roșie) sau reglate în jos (săgeată albastră) în reglare ascendentă ( ȘI ) și reglarea negativă ( F ) a proceselor de răspuns la stimul în serurile ASD. ( G ) Posibile motive de N-glicozilare și O-glicozilare în jurul resturilor de asparagină și serină pentru domeniul glicopeptidului sialilat legat de α2-3. WebLogo a generat grafice de frecvență relativă ale motivului secvenței semnificative. Înălțimile reziduurilor sunt aproximativ proporționale cu probabilitățile lor binomiale.
Imagine la dimensiune completă
Analiza ontologiei genice a MBG-urilor
Analiza rețelei KEGG Pathway și Protein Interaction
În total, 184 din 243 MBG-uri identificate au fost adnotate în DAVID Bioinformatics Resources (versiunea 6.7). Aceste GBM au fost mapate în 6 căi KEGG cu praguri de numărare ≥5 și o valoare P 30 (Figura suplimentară S1). Au fost comparate frecvențele de aminoacizi specifice poziției reziduurilor de asparagină din jur (13 aminoacizi în ambii termeni) și motivul [AVH] [KR] xNxxNxSxxxY (unde „x” indică orice reziduu, [AVH] și [KR] reprezintă Au fost identificate mai multe reziduuri de aminoacizi care ar putea apărea în poziție, iar vineta indică un posibil glicozit) ca un posibil motiv de N-glicozilare în jurul asparaginei (Fig. 3G). Interesant este faptul că motivele xxxxxxQSDxxYK și xxxxxxHGSxSGx au fost supra-reprezentate în mod semnificativ (creștere ori = 81,62 și 67,07) în datele MBG (Fig. 3G), care ar putea reprezenta motive de glicozilare O legate în jurul reziduurilor de serină pentru domeniul glicopeptidului sialilat atașat la α2-3. Cu toate acestea, pentru a confirma în continuare O-glucozite în MBG, aveți în continuare nevoie de studii mult mai detaliate.
Exprimarea și sialoglicozilarea MBG în probe individuale de ser
Western blot a fost efectuat pentru a verifica expresia C8B, serotransferrina (TF), C1QA și APOD în probe individuale de ser. Ca rezultat, expresia C8B și TF a crescut și expresia C1Q a scăzut în patru probe ASD testate comparativ cu patru probe TD, care au fost în concordanță cu rezultatele MS (Fig. 4A). Cu toate acestea, expresia APOD nu a fost semnificativ diferită între eșantioanele TD și ASD (Fig. 4A). LGAM-urile au fost concepute pentru a detecta sialoglicozilarea legată de α2-3 a C8B, TF, C1QA și APOD în 15 probe individuale de ser TD și 15 ASD (Fig. 4B). Ca rezultat, nu s-au detectat diferențe semnificative pentru sialoglicozilarea C8B, TF și C1QA între două grupuri. Totuși, siolocosilarea APOD α2-3 a crescut semnificativ în probele ASD față de probele TD (p = 0,004) (Fig. 4C). Analiza curbei ROC a arătat că nivelurile serice de APOD sialoglicozilat α2-3 au dus la o ASC de 0,88, cu o specificitate de 86,7% și o sensibilitate de 80,6% pentru a diferenția ASD de TD) (Fig. 4D).
( LA ) Analiza Western blot a expresiei C8B, TF, C1QA și APOD în patru probe de ser TD și patru ASD. ( B ) Scanați imagini derivate din LGAM pentru seruri TD și ASD. ( C ) Analiza graficului de cutie a intensităților de legare pentru C8B, TF, C1QA și APOD din 30 de cazuri serice de TD și ASD de către LGAM. Barele de eroare reprezintă intervale de încredere de 95% pentru mijloace. Diferențele semnificative statistic între grupuri sunt indicate de valorile P ( D ) Analiza curbei ROC a APOD sialoglicozilat α2-3 pentru a diferenția probele ASD de probele TD.
Imagine la dimensiune completă
Discuţie
De obicei, acidul sialic se găsește ca o componentă a lanțurilor oligozaharidice ale mucinelor, glicoproteinelor și glicolipidelor care ocupă poziții terminale nereducătoare ale N- sau O-glicanilor. Nivelurile serice de acid sialic sunt asociate cu boli hepatice 46, boli reumatice 47 și diabet de tip 2 48. În acest studiu, analiza Western blot a validat modificarea expresiei C8B, TF și C1QA, dar nu și a expresiei APOD, în probe individuale de ser ASD și TD (Fig. 4A). LGAM-urile au dezvăluit o expresie semnificativ crescută a sialoglicozilării APOD α2-3 în probe individuale de ser ASD, ceea ce explica în mare măsură diferența în expresia proteinei APOD între serurile ASD și TD și a subliniat că atât MBG, cât și sialoglicozilarea lor α2-3 au fost asociate cu ASD. Analiza curbei ROC a indicat că APOD sialoglicozilat ar putea distinge sensibil și specific copiii cu TSA de copiii cu TD ca biomarkeri candidați (ASC = 0,88) și a indicat importanța și necesitatea studierii modificării glicozilării glicoproteinelor din seruri pentru diagnostic de ASD.
În concluzie, expresia antigenelor sialozil-T α2-3 a fost semnificativ crescută în serurile ASD versus TD. Un total de 194 și 217 MBG au fost identificate din seruri TD și respectiv ASD, din care 74 de proteine au fost identificate în mod special sau reglate în sus în serurile ASD. Analiza bioinformatică a relevat că cascada complementară anormală și reglarea celulară aberantă a răspunsului la stimul ar putea fi noi creatori sau markeri ai ASD, oferind noi informații pentru viitoare cercetări aprofundate privind patogeneza ASD. Mai important, LGAM au dezvăluit o expresie semnificativ mai mare a sialoglicozilării APOD α2-3 în probe individuale de ser ASD, care ar putea servi drept potențiali biomarkeri pentru diagnosticul ASD.
Materiale și metode
Aprobarea studiului
Colectarea și utilizarea tuturor probelor de patologie umană pentru cercetarea prezentată aici au fost aprobate de Comitetul de Etică al Universității de Nord-Vest, Spitalul Popular Popular Shaanxi și a Patra Universitate Medicală Militară (Xi'an, China). Participanții au primit consimțământul scris în cunoștință de cauză pentru colectarea întregii salive și seruri. Acest studiu a fost realizat în conformitate cu orientările etice din Declarația de la Helsinki.
Subiecte
Masă completă
Aprobarea pentru această cercetare a fost obținută de la Comitetul de etică și Comitetul de revizuire a cercetărilor umane de la Universitatea Xi'an Jiaotong (Xi'an, China). Toți părinții participanților înscriși la studiu și-au dat consimțământul scris în cunoștință de cauză. Toate experimentele au fost efectuate în conformitate cu liniile directoare aprobate.
Colectarea și pregătirea probelor
Toate probele de sânge au fost colectate de către o asistentă medicală pediatrică și sângele venos a fost colectat. Sângele a fost lăsat să se coaguleze la temperatura camerei timp de 25 de minute. Cheagul a fost apoi îndepărtat prin centrifugare la 1.500 g timp de 10 minute într-o centrifugă refrigerată. Supernatantul rezultat este transferat imediat într-un tub curat de polipropilenă adăugat cu un cocktail inhibitor fără EDTA (inhibitor de protează Halt; Thermo Scientific Pierce Protein Research Products, Rockford, IL, SUA) la o concentrație serică de 10 μL./Ml. Serul produs a fost alicotat în porțiuni mici și înghețat imediat pe gheață uscată și depozitat la -80 ° C. Pentru a normaliza diferențele dintre subiecți și a tolera variațiile individuale, s-au reunit 50 μL din 50 de probe de ser de la subiecți., pentru microarrays de lectină și detectarea LC-MS/MS. Celelalte 15 eșantioane din fiecare grup au fost întreținute individual pentru validare ulterioară.
Lectin Microarray și analiza datelor
Microarray-ul de lectină a fost produs și incubat cu proteine serice fluorescente marcate cu vopsea Cy3 (GE Healthcare) conform protocolului nostru anterior 50, 51, 52, 53, care este descris în detaliu în Materialele și metodele suplimentare. 50 de probe de ser TD și 50 ASD au fost utilizate pentru detectarea microarray-ului de lectină. Douăzeci de microlitri (20 μL) din fiecare probă și 10 probe într-o piscină au fost pregătite pentru a forma subgrupurile TD-1.
5. Imaginile dobândite au fost analizate la 532 nm pentru detectarea Cy3 utilizând software-ul Genepix 3.0. Fundalul mediu este scăzut, iar valorile mai mici decât fondul mediu ± 2 abateri standard (SD) au fost eliminate din fiecare punct de date. Mediana punctului de date eficace pentru fiecare lectină a fost normalizată global la suma mediană a tuturor punctelor de date eficiente pentru fiecare lectină dintr-un bloc. Fiecare probă a fost observată în mod constant cu trei diapozitive repetate, iar mediana normalizată a fiecărei lectine din 9 blocuri repetate a fost calculată în medie și determinată SD. Datele normalizate pentru grupurile TD și ASD au fost comparate în conformitate cu următoarele criterii: modificarea pliurilor ≥1,5 sau ≤0,67 a indicat o reglare ascendentă sau o reglare descendentă. Diferențele dintre cele două seturi de date arbitrare au fost testate de testul t al studentului Paired folosind SPSS Statistics 19. Datele originale au fost analizate în continuare cu Expander 6.0 (//acgt.cs.tau.ac.il/expander/) pentru a realiza un cluster ierarhic analiză.
Microarray seric și analiza datelor
S-a produs un microarray seric utilizând 30 de probe de ser individuale de la 15 copii și 15 copii cu ASD fiecare. MAL-II marcat cu Cy3 a fost aplicat pentru a detecta structura specifică a zahărului în cantitatea minimă de probe de ser care au fost imobilizate pe diapozitive conform protocolului de fabricație al microarray-ului de salivă 51 cu unele modificări. Informații detaliate sunt furnizate în materialele și metodele suplimentare.
Izolarea și digestia MBG-urilor
Conjugații de particule magnetice MAL-II (MMPC) au fost preparați așa cum este descris 54, 55. Două miligrame (
30 μL, măsurat cu reactiv Bradford) de proteine din seruri TD și ASD grupate au fost incubate cu MMPCs 54, 55. Glicoproteinele obținute (aproximativ 150 μg) au fost digerate de tripsină și PNGază F așa cum s-a descris anterior 54, 55, 56. Informații detaliate sunt furnizate în materialele și metodele suplimentare.
Analiza LC-MS/MS
Analiza SM a fost efectuată utilizând un spectrometru de masă LTQ Orbitrap XL (Thermo Scientific). Parametrii detaliați utilizați în acest experiment sunt furnizați în Materialele și metodele suplimentare. Datele brute au fost procesate folosind Proteome Discoverer (versiunea 1.4.0.288, Thermo Fischer Scientific). Spectrele MS/MS au fost căutate cu motorul SEQUEST împotriva bazei de date proteom complete umane UniProt și a bazei de date de contaminanți (Ediția 2013_06, secvențe de proteine 88913). Căutarea a fost efectuată cu următorii parametri: toleranță de masă a precursorului 20 ppm; Toleranță de masă MS/MS 0,6 Da; două scindări ratate pentru peptide triptice; modificări variabile oxidarea (M), Metiltio (C), potrivirile spectrale ale peptidelor (PSM) au fost validate printr-o căutare bazată pe baza de date a momelului (FDR ≤ 0,01).
Cuantificare relativă fără etichete prin calculul indicelui spectral
După identificarea peptidelor, a fost aplicat un algoritm similar cu ProteinExtractor în ProteinScape, care utilizează un scor minim de peptide (minPepScore) și un număr minim de peptide pe proteină (minNrPeps), așa cum este descris 57. Dintre proteinele enumerate, fiecare meci din spectrul peptidic (PSM) a fost extras. Un indice spectral (SI) bazat pe numărul spectral și peptidic a fost calculat așa cum s-a descris anterior 58. Numărul spectral brut pentru proteinele identificate a fost normalizat folosind următoarele formule (Formula 1 și Formula 2):
unde C i este numărul spectral total al cursei i; y este numărul spectral total mediu al tuturor curselor comparate; N i și Ri sunt numărul spectral normalizat și brut al unei proteine în cursul i, respectiv. SI,/C i, a fost folosit pentru a normaliza numărul spectral total al fiecărei curse pentru a reduce variabilitatea cursei-la-curse.
Exploatarea datelor și Bioinformatica
Analiza datelor și software-urile profesionale utilizate în acest studiu sunt descrise în detaliu în Materiale și metode suplimentare.
Lectină/Glyco-Anticorp Microarrays și analiza datelor
informatii suplimentare
Cum se citează acest articol: Qin, Y. și colab. Glicopatternul seric și glicoproteinele care leagă lectina-II de Maackia amurensis în tulburarea spectrului autist. Rep. Științifică. 7, 46041; doi: 10.1038/srep46041 (2017).
Nota editorului: Springer Nature rămâne neutru în ceea ce privește revendicările jurisdicționale privind hărțile publicate și afilierile instituționale.
- Uniunea Rusiei și Belarusului: manevra lui Putin pentru a rămâne la putere Ordinea Mondială -
- Psihologia explică 5 dintre cauzele tulburării alimentare excesive
- Acestea sunt simptomele tulburării bipolare
- Femeile și tutunul în Uniunea Europeană
- Relația dintre tulburarea menstruală și fertilitatea CuidatePlus