Se mai numește carbonat acid de sodiu, carbonat monosodic, sare Vichy sau bicarbonat de sodiu. Acest produs, NaHCO3, este caracterizat ca o pulbere cristalină albă, inodoră, cu gust sărat și ușor alcalină. Solubil în apă și practic insolubil în alcool. Este inalterabil în aer uscat, dar se descompune în umed.
Se dizolvă în 9 părți de apă rece. Dacă această soluție este agitată, o parte din bicarbonat se pierde din cauza evoluției CO 2 și la fel se întâmplă dacă este încălzită la peste 70 ° C. Încălzită la 400 ° C, această sare se transformă în carbonat neutru, cu o pierdere de aproximativ 35% din greutatea sa primitivă.
Carbonatul de sodiu anhidru, cunoscut sub numele de sodă Solvay, sodă pentru rufe, sare sodică sau cenușă sodică, este utilizat în cantități industriale pentru fabricarea sticlei, săpunurilor, hârtiei, a emailurilor și a altor produse chimice, precum și pentru purificarea apei dure.
Bicarbonatul de sodiu este utilizat ca antiacid gastric în medicină. Majoritatea bicarbonatului produs la nivel industrial este utilizat pentru conversia sa în carbonat de sodiu prin încălzire ușoară, conform reacției:
2 NaHCO 3 (s) Na 2 CO 3 (s) + H 2 O (g) + CO 2 (g)
Din punct de vedere biologic, CO 2 și HCO 3 - sunt responsabile pentru rezerva acidă și bazică din organismele vii.
pâlnie de sticlă balon kitasato
Fiolă de decantare tuburi de 15 ml și 100 ml
spală sticla 3 eprubete erlenmeyer balon buchner pâlnie
Pahar de 100 ml 1 buretă
NaCI AgNO3 0,5M
CaCO3 Fenolftaleina (FT)
NH 3 15M (comercial) soluție stoc 0,1 N de HCI
100 ml de HCl 6M (Preparat de elevi) Metil portocaliu (NM)
Sinteza NaHCO3 la nivel industrial se realizează prin metoda Solvay, pe baza reacției care are loc între o soluție saturată de clorură de sodiu în amoniac apos și dioxid de carbon, din care se poate separa bicarbonatul de sodiu solid.
Materiile prime sunt sare obișnuită (NaCl), calcar (compus în principal din CaCO3), ambele materiale cu costuri reduse și amoniac, care pot fi recuperate ulterior din soluția de clorură de amoniu. Pe baza procesului Solvay, vom efectua sinteza bicarbonatului cu următorul sistem de reacție:
În prima parte a sistemului vom produce CO 2, pentru aceasta adăugăm încet HCl peste CaCO3 .
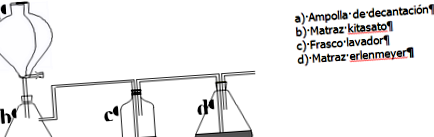
În sticla c spălăm CO 2 eliberat pentru a elimina impuritățile. Când ajunge în balon d reacționează cu soluția saturată de sare comună în amoniac apos, care este format în principal de ioni: NH 4 +, OH -, Cl - și Na + .
CO 2 reacționează cu apă și amoniac pentru a forma NH 4 HCO 3, care se disociază pentru a da monohidrogen carbonat care în cele din urmă, în soluție saturată de NaCI, precipită sub formă de bicarbonat de sodiu
Datorită saturației de CO 2 și a timpului de odihnă pentru cea mai bună cristalizare a bicarbonatului, nu se obține pur, ci amestecat cu carbonat de sodiu. Din acest motiv, procentul din fiecare sare din produsul obținut va fi evaluat și determinat.
METODA DE SINTEZĂ
Mai întâi sistemul de reacție este asamblat. Se prepară 100 ml de HCI 6M; Se cântăresc 8 g NaCl și 40 g CaCO3 .
În vitrina, NaCl comercial este plasat într-un pahar și se adaugă 20 ml de amoniac comercial. Când practic totul este dizolvat, soluția este filtrată peste un balon Erlenmeyer printr-un filtru de pliuri.
HCI 6M este plasat în flaconul de separare (a). În balonul de kitasat (b) puneți CaCO3. Apa este plasată în sticla intermediară de spălare (tubul de sticlă trebuie să fie sub suprafața lichidului). (d) este balonul Erlenmeyer cu soluția saturată de NaCI în amoniac apos.
Odată ce sistemul de reacție este asamblat, adăugăm încet HCI 6M peste CaCO3 și CO 2 evoluat este barbotat peste soluția d timp de 30 de minute. Se lasă să cristalizeze peste noapte și precipitatul obținut este filtrat printr-o pâlnie Büchner; spălat cu 20 ml etanol 50%, uscat în aer.
1. Stabiliți reacțiile care au loc în diferitele zone ale sistemului de colectare.
În zona c a sistemului de reacție, verificați valoarea pH-ului înainte și după trecerea CO 2 .
2. Descrieți aspectul produsului obținut
1. Se dizolvă o porție din produs în 5 ml de apă. Măsurați pH-ul soluției rezultate. Justificați respectivul pH folosind ecuația ionică adecvată.
2. Puneți o a doua porție de produs obținută într-o eprubetă și încălziți-o. Indicați reacția care are loc. Se răcește eprubeta și se adaugă 5 ml de apă. Măsurați pH-ul și comparați-l cu cel obținut în 1. Scrieți ecuația ionică care justifică pH-ul acestei soluții.
3. Puneți o a treia porție de produs într-o eprubetă și adăugați 2 ml de HCl 3 M. Ce gaz este eliberat? Scrieți ecuația chimică corespunzătoare.
4. Dacă se adaugă AgNO3 la soluția apoasă de bicarbonat, se produce un precipitat alb. Ceea ce se poate datora?
DETERMINAREA PROCENTULUI DE NaHCO 3 și Na 2 CO 3
- SODIUM THOSULFATE Speranță 250 mg soluție injectabilă Soluții clinice
- SOSULFAT DE SODIU »Utilizări, formulă și efecte secundare
- Rețete cu bicarbonat de sodiu pentru a arde cu ușurință grăsimile
- Tulburări de sodiu Medicină clinică
- Tabel nutrițional Fasole prăjite, conservate, tradiționale, cu sodiu redus