Scris la 03 februarie 2020.
Indice articol
- Cancerul endometrial-uterin
- epidemiologie
- Factori de risc
- Cancer uterin ereditar
- Anatomie patologică și biologie moleculară
- semne si simptome
- Diagnostic
- Punerea în scenă
- Factori prognostici
- Tratament
- Urmare
- Toate paginile
AUTOR: Dra. Luisa Sánchez Lorenzo
Uterul este un organ gol muscular, în formă de pară inversată. Se află în pelvisul feminin din fața rectului, în spatele vezicii urinare și în contact cu vaginul. În partea superioară a acesteia, de fiecare parte, intră tuburile uterine.
Este împărțit în două părți:
- Corp uterin: este alcătuit din cele două treimi superioare și are două porțiuni: fundul (porțiune rotunjită deasupra intrării trompelor uterine) și istmul (regiunea imediat deasupra colului uterin).
- Cervix sau col uterin care iese în partea superioară a vaginului.
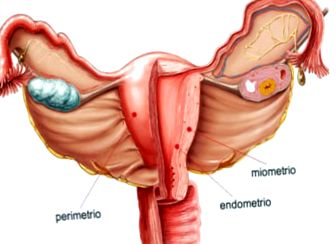
Peretele corpului uterin este format din trei straturi:
- Perimetru: tunică seroasă externă.
- Miometru: mediu tunica, strat gros de țesut muscular neted care este distins în timpul sarcinii. Aici se află principalele vase și nervi ai uterului.
- Endometru: membrană mucoasă internă care se atașează la miometru. Această căptușeală este reînnoită în fiecare lună după menstruație.
Există leziuni uterine benigne care ar trebui monitorizate pentru eventuale complicații. Fibroamele sunt tumori benigne care provin din peretele muscular al uterului. Endometrioza este prezența țesutului endometrial în afara uterului și poate prezenta un risc crescut pentru dezvoltarea altor tumori. Tumorile uterului își au originea mai ales în endometru datorită modificărilor acestor celule.
Date epidemiologice
La nivel global, cancerul uterin este al 7-lea cel mai frecvent neoplasm la femei și al 2-lea neoplasm ginecologic după cancerul de col uterin. Se estimează că 382.000 de cazuri noi (8,4 cazuri/100.000 de femei) au fost diagnosticate în 2018 și s-au înregistrat aproape 90.000 de decese (1,8/100.000 de femei). În țările dezvoltate este cel mai frecvent cancer ginecologic. Ratele de incidență în aceste țări reprezintă 14,7 cazuri/100.000 de femei cu o mortalitate de 2,3/100.000 de femei.
În Spania, cancerul endometrial este al patrulea cel mai frecvent neoplasm la femei cu 6784 de cazuri noi în 2018, aproximativ cu o incidență de 13,7 cazuri/100.000 de femei/an și o mortalitate de 3,6 cazuri/100.000 de femei/an.
Vârsta medie la diagnostic este de 63 de ani, dar mai mult de 90% din cazuri sunt diagnosticate la femei> 50 de ani. 4% dintre pacienți sunt diagnosticați înainte de vârsta de 40 de ani.
75-80% din cazuri sunt diagnosticate în stadiul I cu o rată de supraviețuire la 5 ani de 90%. Din păcate, rata de supraviețuire la 5 ani este mai mică atunci când există o răspândire regională (68%) sau la distanță (17%).
Factori de risc
Majoritatea cazurilor nu pot fi prevenite, dar reducerea factorilor de risc poate reduce șansele de a dezvolta boala.
Este foarte important ca toate femeile să fie conștiente de factorii de risc și simptomele cancerului endometrial.
FACTORI DE RISC
Expunere excesivă la estrogeni:
Vârsta, vârsta mediană la diagnostic 62 de ani.
-
Dacă există antecedente familiale ale unei rude de gradul I (mamă, soră sau fiică), riscul crește de la 50 de ani.
Radioterapia pelviană anterioară pentru un alt neoplasm.
Cancer uterin ereditar
Se consideră că din totalul cancerelor endometriale diagnosticate în prezent, doar 2-5% sunt ereditare, dacă pacientul a fost diagnosticat înainte de vârsta de 50 de ani această cifră crește la 10%.
Riscul populației de a dezvolta cancer endometrial la o femeie este de aproximativ 2%, dar atunci când este legat de un sindrom familial moștenit, riscul său este între 3-50%.
Sindroamele ereditare cel mai frecvent legate de cancerul endometrial sunt S Lynch și S Cowden, acesta din urmă fiind mai puțin frecvent, deoarece este mai rar.
În ultimii ani, sindromul ereditar al cancerului de sân și ovarian (BRCA1/2) a fost, de asemenea, asociat cu dezvoltarea cancerului endometrial, în special în BRCA1, în timp ce relația cu BRCA2 rămâne îndoielnică. Alte sindroame ereditare-familiale posibil legate sunt Peutz-Jeghers Sd și Li-Fraumeni Sd.
Sincronizare SD
BRCA 1/2
Sd cowden
Anatomie patologică și biologie moleculară
Clasic, clasificarea tumorilor este histologică, dar pe măsură ce noi cunoștințe sunt dobândite la nivel de biologie moleculară, le putem încorpora ca informații suplimentare care ne vor permite o mai bună identificare.
Clasificare histologică:
Permite stratificarea tumorilor în funcție de numărul de mutații, fiind capabil să prezică sensibilitatea la imunoterapie (antiPDL-1) și furnizând, de asemenea, informații prognostice.
În practica clinică, se utilizează trei tehnici imunohistochimice (p53, MLH1, MSH2, PMS2, MSH6) și o tehnică moleculară (mutații POLE) cu intenția de a face o aproximare.
POLE/ultramutat
(5-7%)
MSI/hipermutat
(28-30%)
Număr de copii redus
(39%)
Asemănător seros/p53 anormal
(23-26%)
semne si simptome
- Sângerări genitale anormale: simptom cardinal (până la 90% din cazuri)
1. În 45 de ani.
Diagnostic
Confruntat cu oricare dintre semnele și simptomele suspiciunii, pacientul trebuie trimis la un cabinet de ginecologie pentru evaluare.
1. Anamneză dirijată: compilarea factorilor de risc personal și familial al pacientului.
2. Examen ginecologic: inspecție cu un specul și colposcopie, un examen vagino-abdominal care va permite definirea dimensiunii uterului și un examen recto-vaginal pentru a face o aproximare a dimensiunii uterului sau dacă infiltrarea rectului-vaginal septul și parametrii sunt suspectați. Nu uitați să palpați teritoriile ganglionare.
3. Ecografie transvaginală: introducere prin vagin a unei sonde cu ultrasunete care permite măsurarea grosimii endometrului. Punctul de tăiere pentru grosime este de obicei stabilit la 3 mm, care poate fi diferit în funcție de faptul dacă pacientul este pre- și postmenopauză. Dacă grosimea este mai mare sau persistă sângerările ginecologice, testele de diagnostic vor continua.
4. Histeroscopie: este o examinare vizuală a colului uterin și a interiorului uterului cu un tub subțire flexibil. Acest test poate avea scopuri diagnostice și terapeutice. Vederea directă a interiorului uterului ne permite să facem o biopsie a oricărei zone de suspiciune, extracția polipilor, fibroamelor sau cauterizarea zonelor de sângerare. Poate fi efectuat cu sau fără anestezie locală și este o procedură ambulatorie.
5. Biopsie de aspirație endometrială: tehnică minim invazivă și ambulatorie care permite prelevarea de biopsii oarbe de pe fețele uterului și unghiurilor uterine. Sensibilitate ridicată a specificității la femeile pre și postmenopauzale.
6. Biopsie: luarea unui mic fragment al endometrului pentru a confirma diagnosticul suspectat.
Dacă diagnosticul de cancer endometrial este confirmat, se vor solicita teste suplimentare:
7. Markeri tumorali: CA125 este de obicei solicitat, utilitate variabilă în funcție de tipul de histologie.
8. Rectoscopie și cistoscopie: permit vizualizarea directă a rectului și respectiv a vezicii urinare și vor fi evaluate numai atunci când există o suspiciune ridicată de infiltrare tumorală.
9. Teste de imagistică:
la. Rezonanța magnetică pelviană (RMN): test de alegere pentru stadializarea preoperatorie întrucât este cel care evaluează cel mai bine extensia locoregională a tumorii, fiind de interes special grosimea liniei endometriale, existența maselor în interiorul miometrului, gradul de infiltrarea miometrului, implicarea sau nu a colului uterin și evaluarea adenopatiilor mărite.
b. Tomografie computerizată (CT): foarte utilă pentru evaluarea limfadenopatiei și a prezenței metastazelor la distanță.
c. PET-CT: sensibilitate mai mare decât CT sau RMN pentru detectarea metastazelor ganglionare. În prezent, deși este larg acceptat ca parte a studiului inițial de extindere, rolul său principal este în detectarea recurențelor sau în tratamentul unei recurențe locale.
Punerea în scenă
Stadializarea unei tumori ne permite să definim clar dimensiunea, localizarea, extensia locală și îndepărtată (metastază). Stadializarea corectă a unei tumori ne permite să proiectăm strategia terapeutică. Cele două sisteme de clasificare utilizate sunt sistemul TNM și sistemul FIGO, acesta din urmă fiind mai răspândit, dar există o corelație între ambele. Ultima actualizare a sistemului endometrial FIGO este din 2009, fiind cea pe care o folosim în prezent pentru clasificarea carcinoamelor uterine și carcinosarcoame. Sarcoamele de origine uterină (leiomiosarcoame și sarcoame stromale endometriale) vor urma o clasificare diferită a TNM și FIGO.
FIGO 2009 Stadiul cancerului uterin
Etapa I
Tumora s-a limitat la corpul uterin.
AI
Absența invaziei miometrului o Stadiul oncologic este unul dintre cei mai importanți factori de prognostic.
- Gradul 1: ≤ 5% creștere solidă non-scuamoasă sau non-morulară (bine diferențiată).
- Gradul 2: 6% până la 50% creștere solidă non-scuamoasă sau non-morulară (moderat diferențiată).
- Gradul 3: 50% creștere solidă non-scuamoasă sau non-morulară (slab diferențiată sau nediferențiată).
Tratament
Tratamentul chirurgical inițial al cancerului endometrial:
Chirurgia este coloana vertebrală a tratamentului. La acei pacienți cu cancer endometrial IAG1 subtip endometrioid și fără dorințe genetice îndeplinite, aceștia ar trebui evaluați într-un comitet pentru a lua în considerare amânarea tratamentului chirurgical definitiv.
Tratament adjuvant:
Adecvarea tratamentului după abord chirurgical este definită pe baza riscului de recidivă. Aceste grupuri au fost realizate pe baza factorilor de prognostic clinicopatologic.
Tratamentul recidivei:
La pacienții diagnosticați cu recidivă locală (între 25-40%), înainte de a propune orice tratament, biologia tumorii, intervalul fără boală, numărul leziunilor și localizarea, tratamentele anterioare, rezecabilitatea și starea generală a pacienților.
La pacienții cu recidivă sistemică, tratamentul va depinde de histologie și biologie moleculară. La acei pacienți cu tumori endometrioide de grad scăzut și receptori hormonali pozitivi, va fi luat în considerare tratamentul cu terapie hormonală. În tumorile de grad înalt sau histologiile non-endometrioide, tratamentul standard va consta din carboplatină și paclitaxel. Recent, tratamentele de imunoterapie de linia a doua și a treia au arătat rate de răspuns ridicate ca monoterapie la pacienții cu deficit de gene reparatoare sau mutație în POLE sau în combinație (pembrolizumab și lenvatinib), indiferent de starea genelor reparatoare. Există deja studii cu imunoterapie de primă linie în curs pentru care nu avem încă rezultate. În contextul bolii metastatice, studiile clinice ar trebui să fie întotdeauna o opțiune de luat în considerare.
Viitorul terapeutic:
Pentru pacienții aflați în stadii inițiale, obiectivul este:
- Proiectați noi metode de detectare.
- Proiectați protocoale de gestionare a nodului santinelă.
- Proiectați noi terapii hormonale cu intenția de a păstra fertilitatea în special la pacienții tineri.
- Scade toxicitatea legată de radioterapie.
- Integrarea profilului molecular în tratamentul adjuvant, astfel încât, în funcție de profil, să fie evaluată adecvarea radioterapiei în stadiile inițiale și chiar clarificat beneficiul chimioterapiei la pacienții cu risc ridicat.
Pentru pacienții în stadii avansate:
- Cele mai studiate căi sunt imunoterapia și PI3K/AKT/mTOR (70% din studii împotriva țintelor moleculare în cancerul endometrial).
- În imunoterapie predomină inhibitorii punctului de control. Acestea prezintă un interes special în grupurile ultra și hipermutate, deoarece au o cantitate mai mare de neoantigene, infiltrație limfocitară și expresie a PD1/PDL1.
- Calea PI3K/AKT/mTOR pare a fi de interes special în subtipul scăzut al numărului de copii și subtipul endometrioid. Predomină combinațiile cu terapia hormonală. Există deja un anumit grad de dovezi în studiile clinice cu temsirolimus, letrozol-everolimus și temsirolimus-bevacizumab.
Urmărirea
Cele mai multe recidive apar în primii trei ani după diagnostic. Obiectivul urmăririi constă într-o detectare timpurie a reapariției bolii și permite, de asemenea, controlul impactului tratamentului asupra calității vieții.
Cele mai multe recidive sunt simptomatice, cele mai frecvente fiind prezența sângelui în urină (hematurie), sânge în scaun (rectoragie/hematochezia) și sângerări vaginale; în caz de prezentare, pacientul trebuie trimis la consultare pentru evaluare.
Analizele vor fi determinate în funcție de riscul de recidivă, dar, în general, vor fi efectuate la fiecare 3-6 luni în primii doi ani după terminarea tratamentului și ulterior cel puțin până la al cincilea an la fiecare 6-12 luni.
Fiecare analiză ar trebui să includă o serie de întrebări care ne pot determina să suspectăm o recurență locală, cum ar fi dacă au existat sângerări, durere, tulburări gastro-intestinale sau disurie. De asemenea, trebuie să ne întrebăm despre efectele adverse pe termen scurt și lung ale tratamentului. Ar trebui folosit pentru a promova obiceiuri de viață sănătoase la birou. Ar trebui efectuată o examinare fizică completă cu palparea lanțurilor ganglionare și examinarea abdominală; examinarea ginecologică va include cel puțin o examinare cu speculum, examinare bimanuală și biopsie a oricărei leziuni suspecte de debut nou. Citologia vaginală în urmărirea cancerului de col uterin nu este recomandată și este chiar considerată o practică inadecvată. Determinarea markerului tumoral Ca125 în timpul urmăririi poate fi luată în considerare la acei pacienți cu diagnostic crescut sau histologie seroasă, dar nu face parte din urmărirea obișnuită.
Testele imagistice (radiografie toracică, tomografie computerizată sau ultrasunete abdominale) la pacienții asimptomatici detectează între 0-30% din recidive, deci nu sunt recomandate sistematic. Adecvarea efectuării unor teste imagistice în urma monitorizării ar trebui, de asemenea, să fie evaluată individual, cum ar fi în cazurile FIGO din stadiul III-IV la momentul diagnosticului, unde poate fi recomandată o tomografie computerizată toracică-abdomen-pelvis. Semestru în timpul primului 2-3 ani.
Efectele adverse pe termen lung ale tratamentului:
- Colesterolul HDL atunci când calitatea contează mai mult decât cantitatea - Societatea Spaniolă de Cardiologie
- Antioxidanți vegetali, Parkinson și Alzheimer Societatea spaniolă de dietă și știință
- Am participat la cea de-a XIV-a întâlnire cu privire la obezitate, diabet și nutriție a Societății Spaniole de Medicină
- Buletinul Societății Spaniole de Biologie
- O alimentație sănătoasă și durabilă, provocarea societății din secolul 21 - Gaceta Médica