- Subiecte
- rezumat
- Introducere
- Distribuția și riscul de grăsime corporală
- Depozitarea și eliberarea acidului gras.
- Formarea adipokinelor în țesutul adipos regional.
- Leptina
- Adiponectina
- Citokine inflamatorii
- Alte adipokine
- Pierderea și boala de grăsime gluteofemorală
- Excesul de glucocorticoizi
- Lipodistrofia
- Concluzie
Subiecte
rezumat
Introducere
Obezitatea este definită ca un indice de masă corporală (IMC)> 30 kg m – 2 și un IMC crescut a fost asociat cu un risc ridicat de boli cardiovasculare și diabet. 1 Se știe de mult că distribuția grăsimii corporale este, de asemenea, un factor de risc important: raportul dintre grăsimea abdominală și cea gluteofemorală, măsurat, de exemplu, prin raportul talie-șold, este corelat cu bolile asociate cu obezitatea și mortalitatea și este un marker de risc cardiovascular mai puternic decât IMC. 2, 3, 4 Aici, analizăm dovezile că grăsimea gluteofemorală este protectoare și posibilele mecanisme care ar putea fi implicate.
Distribuția și riscul de grăsime corporală
Mai multe studii populaționale susțin faptul că riscurile pentru sănătate asociate cu obezitatea depind de acumularea de grăsime abdominală. Obezitatea abdominală este asociată cu o creștere a tensiunii arteriale și a nivelurilor de trigliceride plasmatice (TG). 2, 3 Este, de asemenea, un predictor independent pentru dezvoltarea diabetului de tip 2. 5 5
Efectul advers al obezității abdominale apare din combinația disfuncției țesutului adipos subcutanat și acumularea de grăsime viscerală care devine evidentă atunci când indivizii cu un raport crescut talie-șold sunt studiați cu tehnici imagistice. 6, 7, 8 Importanța deosebită a acumulării de grăsime viscerală față de disfuncția de stocare subcutanată a grăsimii a fost recent pusă la îndoială 9, 10, deoarece există dovezi din ce în ce mai susținute că adipocitele viscerale sunt fenotipic diferite de adipocitele subcutanate. unsprezece
Masă completă
Efectul protector al grăsimilor gluteofemorale a fost confirmat, de asemenea, în studiile cu populație numeroasă. În studiul AusDiab, o circumferință mai mare a șoldului a fost asociată cu o prevalență mai mică a diabetului zaharat nediagnosticat și a dislipidemiei. 27 Studiul INTERHEART, alcătuit din 27.000 de participanți, a stabilit o asociere independentă între circumferința mai mare a șoldului și riscul mai mic de infarct miocardic. 4 În studiul prospectiv european privind cancerul și nutriția - studiu prospectiv Norfolk, circumferința mai mare a șoldului a fost asociată cu o proporție mai mică de risc de boli coronariene. În plus, circumferința șoldului a fost asociată pozitiv cu nivelurile plasmatice de acid ascorbic, un factor antioxidant despre care se crede că contribuie la protecția endotelială. 29
Studiile recente fiziologice și moleculare care clarifică posibilele mecanisme care pot contribui la rolul protector al depozitului gluteofemoral vor fi în centrul acestei revizuiri. S-a sugerat că țesutul adipos subcutanat acționează ca un tampon pentru aportul zilnic de lipide în dietă, protejând alte țesuturi de revărsarea lipidelor cu lipotoxicitate asociată. 30 Proprietățile protectoare ale grăsimilor gluteofemorale ar putea fi derivate dintr-un management local diferențiat al absorbției și eliberării acizilor grași. De fapt, acumularea de grăsime femurală care este tipică modelului de distribuție a grăsimii feminine este asociată cu activitatea crescută a lipoproteinelor lipazice ale țesutului adipos. 31,32 Având în vedere protecția metabolică și cardiovasculară transmisă de modelul de distribuție a grăsimilor ginoide, acest lucru susține ideea că grăsimea gluteofemorală este o „chiuvetă metabolică” protectoare. 33
O altă posibilitate este că există o secreție diferențială de proteine legate de țesutul adipos, adică adipokine. După cum se va discuta mai târziu, țesutul adipos gluteofemoral ar putea contribui la un profil adipokinic protector prin secretarea mai multor adipokine „benefice” și mai puține molecule pro-inflamatorii în comparație cu grăsimea abdominală.
În cele din urmă, condițiile care duc la pierderea de grăsime gluteofemorală, cum ar fi excesul de glucocorticoizi cronici în sindromul Cushing (CS) sau lipodistrofia parțială, duc la anomalii metabolice care subliniază proprietățile protectoare ale acestui depozit distinct de țesut adipos.
Depozitarea și eliberarea acidului gras.
Metabolismul țesutului adipos este un proces complex și foarte reglementat, care depinde de mai mulți factori. 34 Una dintre principalele funcții ale țesutului adipos subcutanat este stocarea pe termen scurt și lung de energie ca TG pentru a umple corpul cu energie sub formă de acizi grași neesterificați, eliberați în perioadele de exercițiu, de post sau de foame. . Factorii determinanți importanți ai traficului local de acizi grași din țesutul adipos sunt rata lipolizei, rata de depozitare a TG, care are loc în principal după mese și fluxul de sânge în paturile tisulare. 35 Variațiile acestor factori pot fi responsabile de efectele benefice ale depozitelor de grăsimi gluteofemurale.
Insulina este un inhibitor major al lipolizei în țesutul adipos. Distribuția grăsimii corporale are un efect asupra inhibării lipolizei: adipocitele izolate de la femeile obeze din corpul superior sunt mai puțin sensibile la insulină comparativ cu cele ale femeilor obeze din partea inferioară a corpului. 36 Catecolaminele cresc lipoliza în adipocitele izolate. Cu toate acestea, există diferențe semnificative între depozite în ceea ce privește acest răspuns. Adipocitele abdominale au prezentat o creștere de patru până la cinci ori a lipolizei în timpul stimulării noradrenalinei comparativ cu adipocitele gluteale. 37 Aceasta este mediată de expresia crescută a beta-adrenoceptorilor în depozitul abdominal. 38
Absorbția acizilor grași din chilomicronele bogate în TG din mese depinde de expresia lipoproteinei lipazei (LPL) de către adipocite. În adipocite și segmente de grăsime izolate, expresia ARNm LPL este mai mare în celulele abdominale decât în celulele gluteale. 39 Cu toate acestea, situația este probabil mai complexă, în principal datorită reglementării complexe post-transcripționale a LPL. 40 Acest lucru este observat atunci când se analizează dimorfismul sexual al distribuției grăsimilor: activitatea LPL este mai mare în adipocitele abdominale ale bărbaților și în adipocitele gluteale ale femeilor, comparativ cu celălalt depozit. 31,39 La bărbați, testosteronul suprimă activitatea LPL în coapsă, contribuind la acumularea de grăsime abdominală. 41 Prin urmare, este probabil ca formarea depozitelor de grăsime specifice sexului să fie parțial reglementată de LPL.
Ca urmare a complexității metabolismului țesutului adipos uman, studiul depozitelor de grăsime in vivo este singura modalitate care permite integrarea factorilor care nu sunt prezenți in vitro. Grăsimea superioară a corpului este principalul factor care contribuie la acizii grași sistemici neesterificați, prin urmare prezintă o rată mai mare de lipoliză comparativ cu depunerea mai mică de grăsime corporală. 42, 43 Rata de acțiune a enzimei lipazei sensibile la hormoni, o enzimă cheie în lipoliză, este mai mică în gluteus decât în rezervorul abdominal. 44 Înfometarea timp de 72 de ore produce lipoliză crescută în depozitul abdominal, dar nu și în grăsimea gluteofemorală. 45 În timpul stimulării epinefrinei, lipoliza abdominală pare a fi mai mare decât lipoliza femurală, atunci când este măsurată ca eliberare de glicerol prin microdializă. 46 Eliberarea de palmitat, un marker direct al lipolizei, este mai mică în grăsimea picioarelor în comparație cu depunerea abdominală în timpul stimulării sistemice beta-adrenoceptoare. 47
Diferențe regionale pot fi găsite și atunci când se studiază in vivo absorbția acizilor grași. O constatare consecventă, foarte în concordanță cu ratele mai mici de lipoliză în grăsimea corporală gluteofemorală, este că grăsimea abdominală absoarbe acizii grași derivați din mese cu o aviditate mai mare decât grăsimea corporală mai mică pe o bază de zi cu zi. 48,49 Aceasta susține ipoteza că grăsimea subcutanată este o „chiuvetă” metabolică, cea mai mare parte a tamponării zilnice a acizilor grași fiind gestionată de grăsimea abdominală. Cu toate acestea, traficul exact de acizi grași ar putea fi mai complex, având în vedere prezența unor căi diferite presupuse pentru cifra de afaceri a lipoproteinelor cu densitate foarte mică și, de exemplu, cifra de afaceri a acizilor grași neesterificați. Acestea, precum și reglarea depunerii de acizi grași pe termen lung în depozitele inferioare de grăsime corporală, sunt slab înțelese și necesită studii suplimentare.
Fluxul sanguin al țesutului adipos (ATBF) este un factor determinant important al metabolismului grăsimilor care poate fi studiat doar in vivo. Variațiile fluxului sanguin permit reglarea eliberării acizilor grași neesterificați în circulația sistemică și disponibilitatea substratului pentru LPL după masă. În schimb, ATBF crește în perioadele de foame și postprandial. 50, 51 Interesant este că creșterea postprandială a ATBF nu este un efect direct al insulinei, ci este mediată în principal de catecolamine și oxid nitric. 52, 53
Modificările ATBF în depozitarea grăsimii abdominale au fost bine studiate în diferite condiții; cu toate acestea, se știe puțin despre reglarea ATBF în depozitul de grăsime al corpului inferior. S-a demonstrat că grăsimea gluteală are un ATBF inițial mai scăzut, 44, iar la femeile slabe, ATBF femural a prezentat o creștere atenuată în timpul stimulării sistemice a epinefrinei comparativ cu grăsimea abdominală. 46 Postprandial, ATBF crește atât în depozitele abdominale cât și în cele femurale la femei, dar numai în depozitele abdominale la bărbați. 49 Va fi nevoie de mai multe studii pentru a elucida mecanismele exacte din spatele reglării diferențiale ATBF a celor două rezervoare.
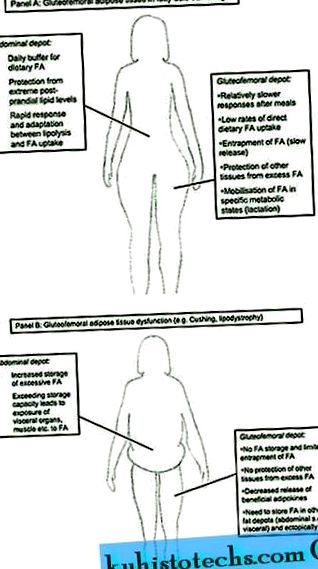
Rolul țesutului adipos gluteofemoral în metabolismul zilnic ( la ); disfuncție a țesutului gluteofemoral și sănătatea metabolică ( b ). Abrevieri: FA, acid (i) gras (i); sc, subcutanat.
Imagine la dimensiune completă
Formarea adipokinelor în țesutul adipos regional.
Se știe că țesutul adipos secretă mai mulți hormoni numiți adipokine. Termenul „adipokine” reprezintă sursa comună a acestor hormoni 57, dar nu ia în considerare faptul că acestea sunt de fapt secretate de diferite tipuri de celule din țesut. Prin urmare, în timp ce adipokinele precum adiponectina și leptina sunt produse de adipocite, interleukinele sunt secretate în principal de macrofagele rezidente. Oriunde provin, adipokinele fac parte dintr-o cascadă de semnalizare care este doar parțial înțeleasă, permițând comunicarea între țesutul adipos și alte organe, în primul rând creierul și ficatul. Existența unei astfel de rețele de comunicații nu este surprinzătoare având în vedere rolul central al țesuturilor în depozitarea și eliberarea grăsimilor și necesitatea coordonării și controlului poftei de mâncare, a foametei și a sațietății, care fac obiectul reglementării centrale. Întrebarea care se pune este dacă proprietățile protectoare ale grăsimii inferioare sunt asociate cu un profil benefic în metabolismul adipokinelor.
Diferențele în expresia genei adipokinei și secreția in vitro sunt bine stabilite atunci când se compară grăsimea subcutanată și cea viscerală. 11, 58 Cu toate acestea, se știe puțin despre diferențele dintre grăsimea superioară și inferioară a corpului.
Leptina
Adiponectina
Citokine inflamatorii
Alături de adipokinele „clasice” leptina și adiponectina, mai multe dintre așa-numitele citokine inflamatorii au fost identificate ca fiind secretate de țesutul adipos. Aceasta este recunoscută drept una dintre legăturile dintre obezitate și dezvoltarea bolilor cardiovasculare, rezistența la insulină și diabet, deoarece procesele inflamatorii fac parte din fiziopatologia acestor boli. Citokinele cele mai analizate sunt factorul de necroză tumorală alfa (TNF-α) și interleukina 6 (IL-6).
IL-6 este o citokină inflamatorie care, similar cu TNF-a, este secretată de o varietate de celule și țesuturi, 116 inclusiv țesutul adipos. Acolo, este secretat atât din adipocite, cât și din celulele fracției stromavasculare, iar nivelurile de secreție sunt corelate pozitiv cu obezitatea. 117, 118 Nivelurile plasmatice sistemice ale IL-6 se corelează cu masa de grăsime viscerală și există o asociere negativă slabă cu suprafața crescută a grăsimii coapsei. 119 Nu există studii care să compare producția regională de IL-6 între grăsimea superioară și inferioară a corpului, dar măsurarea directă in vivo a concentrațiilor de IL-6 și IL-6 a arătat că țesutul abdominal eliberează IL-6, dar nu și receptorul dumneavoastră. 111, 112 Deși rezistența la insulină și bolile cardiovasculare sunt considerate procese inflamatorii cronice parțial de grad scăzut, rolul IL-6 în dezvoltarea rezistenței la insulină rămâne controversat. 120 Există în prezent o lipsă de date privind lansarea regională a IL-6 și acesta este un domeniu de cercetare viitoare.
Alte adipokine
În prezent, există alte câteva adipokine cunoscute și unele dintre ele prezintă corelații interesante între nivelurile sistemice și parametrii de distribuție a grăsimii corporale. De exemplu, nivelurile plasmatice ale proteinei 4 care leagă retinolul, o proteină eliberată de adipocite și asociată cu rezistența la insulină, 121 se corelează cu masa de grăsime a trunchiului. 122, 123 În plus, vaspinul seric, o adipokină sensibilizantă la insulină, prezintă un dimorfism sexual interesant, cu niveluri mai ridicate la femei. 124 Pentru acestea și pentru alte adipokine emergente, se știe puțin despre rolul specific al țesutului adipos regional în producția, secreția și funcția sa în metabolismul uman.
Pierderea și boala de grăsime gluteofemorală
Până în prezent, au fost evidențiate proprietățile benefice ale depozitului de grăsimi gluteofemorale. O altă perspectivă care subliniază caracteristicile sale de protecție este de a elucida ce se întâmplă atunci când se pierd cantități substanțiale de grăsime gluteofemorală. De fapt, pierderea de grăsime în corpul inferior este asociată cu anomalii metabolice.
Excesul de glucocorticoizi
Lipodistrofia
Efectul dăunător al pierderii de grăsime gluteofemorală este cel mai evident în sindroamele lipodistrofice. Lipodistrofia se caracterizează prin absența parțială sau totală a țesutului adipos și poate fi moștenită sau dobândită. 134 Pierderea țesutului adipos duce la acumularea de grăsime ectopică, în conformitate cu ideea că grăsimea subcutanată este o „chiuvetă metabolică” pentru excesul de energie. 33, 135 Acumularea de grăsime ectopică are loc în ficat, pancreas și mușchi. De asemenea, în funcție de tipul de lipodistrofie, există acumularea de grăsime în depozite specifice de grăsime neatrofice, de exemplu, gâtul.
Pacienții cu lipodistrofie parțială familială dominantă autosomală de tip Dunnigan pierd în principal grăsimea subcutanată din brațe și picioare. 135 Acești pacienți prezintă rezistență severă la insulină, anomalii ale profilului lipidic, hipertensiune și dezvoltă diabet. 136, 137, 138 Mai multe mutații ale genei LMNA și ale genei PPARG au fost identificate ca mecanism molecular răspunzător de dezvoltarea lipodistrofiei parțiale familiale. 134 mutații PPARG oferă o posibilă legătură între disfuncția țesutului adipos și profilul metabolic asociat cu acest tip de lipodistrofie, deoarece țesutul adipos nu pare să răspundă mecanismelor de reglare fiziologică la acești pacienți. 138
În schimb, pacienții cu lipodistrofie parțială dobândită (sindromul Barraquer-Simons), care își pierd treptat țesutul adipos de pe față și din partea superioară a corpului, dar depun cantități mari de grăsime în regiunea gluteofemorală, prezintă o rezistență ușoară la insulină și au o prevalență mai mică a diabetului comparativ cu alte sindroame lipodistrofice. 134, 139
Concluzie
- Grăsimea corporală poate reprezenta un risc mai mare pentru sănătate decât tama; sau corp
- Grăsime combinată cu zahăr, un elixir pentru grăsimea corporală; Sănătate; Blogul MASmusculo
- Scortisoara te poate ajuta sa slabesti si sa tratezi diabetul. Salud La Revista El Universo
- Vinetele te ajută să reduci grăsimea abdominală - Mai bine cu sănătatea
- Alăptarea ca factor de protecție împotriva cancerului de sân: o revizuire bibliografică - Revista