Arhive Bronconeumologie este un jurnal științific care publică studii prospective de cercetare originale cu mare prioritate în care sunt prezentate rezultatele legate de diferite aspecte epidemiologice, fiziopatologice, clinice, chirurgicale și de bază ale bolilor respiratorii. Sunt publicate și alte tipuri de articole, cum ar fi recenzii, editoriale, unele articole speciale de interes pentru societate și jurnal, scrisori științifice, scrisori către editor și imagini clinice. În fiecare an, publică 12 numere regulate și câteva suplimente, care conțin aceste tipuri de articole într-o măsură mai mare sau mai mică. Manuscrisele primite sunt evaluate de editori în primă instanță, apoi sunt trimise spre examinare de către experți (procesul de evaluare inter pares sau „evaluare inter pares") și sunt editate de unul dintre redactorii echipei.
Revista este publicată lunar în spaniolă și engleză. Prin urmare, trimiterea manuscriselor scrise în spaniolă și engleză este acceptată în mod interschimbabil. Biroul de traducători efectuează traducerea corespunzătoare.
Manuscrisele vor fi trimise întotdeauna electronic prin intermediul site-ului web: https://www.editorialmanager.com/ARBR/, link accesibil și prin pagina principală a Arhivelor Bronconeumologiei.
Accesul la orice articol publicat în jurnal, în oricare dintre limbi, este posibil prin intermediul site-ului său web, precum și prin intermediul PubMed, Science Direct și alte baze de date internaționale. În plus, Revista este prezentă pe Twitter și Facebook.
Arhive Bronconeumologie Este corpul oficial de exprimare al Societății Spaniole de Pneumologie și Chirurgie Toracică (SEPAR) și al altor societăți științifice, cum ar fi Societatea Latino-Americană de Torace (ALAT) și Asociația Ibero-Americană de Chirurgie Toracică (AICT).
Autorii își pot trimite articolele la Deschideți arhivele respiratorii, Titlu complementar acces liber al revistei.
Indexat în:
Conținut actual/Medicină clinică, JCR extins SCI, Index Medicus/Medline, Excerpta Medica/EMBASE, IBECS, IME, SCOPUS, IBECS
Urmareste-ne pe:
Factorul de impact măsoară numărul mediu de citații primite într-un an pentru lucrările publicate în publicație în ultimii doi ani.
CiteScore măsoară numărul mediu de citări primite pentru fiecare articol publicat. Citeste mai mult
SJR este o valoare prestigioasă, bazată pe ideea că toate citatele nu sunt egale. SJR folosește un algoritm similar cu rangul de pagină Google; este o măsură cantitativă și calitativă a impactului unei publicații.
SNIP face posibilă compararea impactului revistelor din diferite domenii de subiecte, corectând diferențele de probabilitate de a fi citate care există între revistele de subiecte diferite.
Bazele imunologice ale BPOC. Inflamaţie
Fig. 2. Modul de acțiune al metaloproteazelor (MMP). MMP-urile sunt eliberate inactive sub formă de proenzimă sau ca enzimă legată de inhibitori tisulari (TIMP). Activarea acestuia are loc prin oxidarea proenzimei sau prin degradarea inhibitorilor. Odată activată, funcția sa de protează degradează alte proteine, atât structurale (matrice extracelulară), cât și reglatoare (alfa-1 antitripsină, alte MMP și alți inhibitori de proteine).
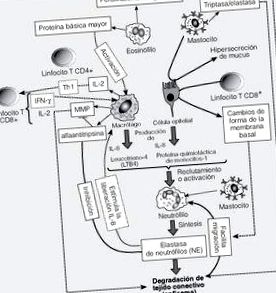
Relevanța eozinofilelor în BPOC este dezbătută, din cauza dezacordului dintre datele care indică sau nu creșterea lor 19,20 sau că acestea sunt prezente într-o formă inactivă 14. Este de remarcat faptul că numărul de eozinofile poate fi văzut crescut în peretele căilor respiratorii în timpul exacerbărilor BPOC la subiecți non-atopici, alături de expresia crescută a citokinelor interleukinice (IL) 4 și 5 și a chemokinelor atragători de eozinofili RANTES Celule T exprimate și secretate), eotaxină și MCP (proteină chemoattractantă monocitară) 4 21. Prezența eozinofilelor este prezentată ca un predictor al răspunsului la tratamentul cu steroizi 22,23. În BPOC, a fost descrisă și o creștere a mastocitelor 24, care ar putea fi implicată în recrutarea neutrofilelor prin eliberarea factorilor chimiotactici, deteriorarea țesuturilor datorită acțiunii diferitelor enzime (triptază, chimază și elastază) și hipersecreție de mucus prin acțiunea chimazei 25 .
Fig. 3. Stresul oxidativ și efectele sale. Radicalii liberi oxidanți sunt prezenți în fumul de tutun și sunt, de asemenea, produși de celulele cu răspuns imun. Dacă încărcătura sa depășește sistemele antioxidante de detoxifiere, se produce stres oxidativ, care provoacă daune directe celulelor structurale, modifică producția de citokine și proteaze de către neutrofile și macrofage și inhibă sistemele antiprotează. De asemenea, afectează acțiunea histone deacetilaze (HDAC) și acetilaze (HAT), parte a mașinilor de remodelare a cromatinei, blocând HDAC-urile și favorizând acetilarea și configurația dezvoltată a cromatinei. Această configurație facilitează cuplarea la ADN a factorilor de reglare a mașinilor transcripționale și induce expresia genelor pro-inflamatorii. De asemenea, blochează acțiunea terapeutică a corticosteroizilor, unul dintre ale cărui mecanisme este recrutarea HDAC în nucleul celular.
Există dovezi acumulate abundente cu privire la existența stresului oxidativ la fumători și la subiecții cu BPOC în plămâni și la o scară sistemică 45-47, precum și date care raportează creșterea markerilor indirecți ai stresului oxidativ cu dezvoltarea fluxului de aer obstructiv limitare 48.49. Fumul de țigară induce expresia diferențiată a diferitelor gene implicate în răspunsul la stresul oxidativ din epiteliul bronșic, iar aceste diferențe sunt amplificate la fumătorii care dezvoltă BPOC 50. Oxidanții din fumul de țigară pot fi implicați în manifestările sistemice ale BPOC, cum ar fi disfuncția mușchilor scheletici și respiratori și pierderea în greutate. Stresul oxidativ la acești subiecți este cauzat de diverși radicali liberi, inclusiv anioni superoxizi (O 2) eliberați de macrofagele alveolare sau derivate din reacțiile xantină/xantină oxidază 51, oxid nitric (NO) 52, monoxid de carbon (CO), etan 53 și lipide produse de peroxidare, inclusiv derivați ai peroxidării acidului arahidonic (izoprostani) 54,55 .
Modificări structurale pulmonare în BPOC. Studiu de remodelare
Modificări structurale ale căilor respiratorii
Fig. 4. Biopsia bronșică a unui pacient cu boală pulmonară obstructivă cronică. A) Secțiunea histologică arată: acini glandulari mucoși abundenți (Gl) și mușchi netezi (MS) și foarte aproape de epiteliu, semn care reflectă creșterea acestor structuri; Zonele de fibroză de localizare subepitelială (Fb), care sunt observate ca depozite hialine practic acelulare, și celule abundente de calici (Cal), cu aspect hipertrofic. Aceste modificări structurale sunt însoțite de inflamație cu infiltrare mononucleară (B), prezență de neutrofile (C) și eozinofile (D). Se observă, de asemenea, zone de distrugere a ciliilor epiteliului bronșic (E). Barele de scalare: 50 µm în A; 10 um în B-E. Pata: hematoxilin-eozină.
Metaplazia scuamoasă, pierderea cililor în epiteliul bronșic, hiperplazia celulelor calice, hipertrofia plus hiperplazia ductală și dilatarea glandelor submucoase și creșterea masei musculare netede au fost descrise în căile respiratorii centrale 83-89. O măsurare tradițională a măririi glandulare bronșice este indicele Reid 90 sau raportul dintre grosimea glandulară și grosimea peretelui. Deși fibroza subepitelială sau grosimea crescută a membranei bazale nu a fost considerată în mod clasic o modificare caracteristică a BPOC, a fost observată la un subgrup de pacienți care prezintă infiltrare inflamatorie eozinofilă. În afară de acest grup în special, prezența fibrozei subepiteliale a fost descrisă în BPOC 91, deși lipsesc datele cantitative despre semnificația sa.
Modificări structurale ale parenchimului pulmonar
În BPOC, emfizemul contribuie la limitarea fluxului de aer, prin acțiunea comună a 2 mecanisme: reducerea retragerii elastice a plămânului care afectează capacitatea de a produce presiuni generatoare de flux și reducerea sarcinii care se opune închiderii ale căilor respiratorii, prin distrugerea ancorelor peretelui alveolar. Laennec 96 a fost probabil primul care a sugerat, la începutul secolului al XIX-lea, că căile respiratorii periferice erau principalul loc de obstrucție în emfizem și că scăderea retracției elastice a plămânului a contribuit la limitarea fluxului de aer. Modificările mecanice din ambele forme de emfizem diferă 97. În emfizemul panacinar, complianța pulmonară este mai mare și creșterea sa se corelează cu reducerea fluxului de aer, care pare să apară în primul rând în funcție de pierderea retracției elastice a parenchimului. În emfizemul centrilobular, componenta inflamatorie a căilor respiratorii periferice este mai mare și poate fi principalul determinant al pierderii fluxului de aer, cu care este corelată.
Sumar si CONCLUZII
- Arhive miere - Farmacia Salburua
- Cele 8 s; simptome de inflamație suspectată; n cr; singur, o patologie; la periculos și tăcut
- Pierdere în greutate archivos - Herboristul dvs. și multe altele
- Arhivele Pentagonului Orele pierdute
- Arhive de presă