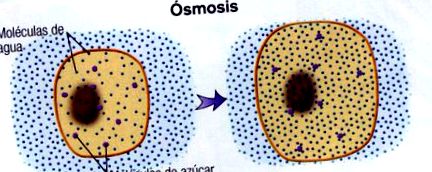
Osmoza este un proces foarte important atât la nivel chimic, cât și biologic.
Dar, Ce este osmoza? Osmoza este un fenomen în care trecerea sau difuzia unui solvent are loc printr-o membrană semipermeabilă, care permite trecerea solventului, dar nu și a solventului, de la o soluție mai diluată la una mai concentrată.
Capacitatea apei de a traversa membrana plasmatică, care se comportă ca o membrană semipermeabilă, depinde de diferența de concentrație dintre fluidele extracelulare și intracelulare și este determinată de prezența sărurilor minerale și a moleculelor organice dizolvate.
Mediile apoase separate de membrane semipermeabile pot avea concentrații diferite și se numesc:
- Hipertonic, cele cu o concentrație mare de substanțe dizolvate comparativ cu altele în care concentrația este mai mică.
- Hipotonic, cele care conțin o concentrație scăzută de substanțe dizolvate în comparație cu altele care o au mai mare.
Moleculele de apă difuzează de la mediul hipoton la mediul hipertonic determinând o creștere a presiunii pe fața membranei compartimentului hipotonic, numită presiune osmotica. Ca o consecință a procesului osmotic, se poate ajunge la echilibru, egalând concentrațiile, iar media va fi izotonică, adică au aceeași concentrație.
Osmoza în bucătărie
Nu suntem conștienți, dar putem vedea osmoza în bucătăria noastră: când fierbem paste sau orez, când pregătim cartofi încrețiți, când înmuiem frunze de salată sau leguminoase
Dacă punem o frunză de salată uscată în apă, aceasta își recuperează toată textura în câteva ore. Salata verde își pierduse apa și o recâștigă datorită osmozei.
Un experiment foarte simplu de realizat pentru a demonstra acest fapt poate fi realizat cu două ouă de pui, oțet și două soluții: una foarte concentrată într-o substanță dizolvată (de exemplu sare) și alta cu doar apă distilată.
După cum putem vedea în experiment, oul care se află într-o soluție foarte concentrată de sare (hipertonică), tinde să expulzeze apa, devenind mai ridată, în timp ce atunci când se află în apă distilată (soluție hipotonică), se umflă. Același experiment poate fi realizat testând diferite soluții concentrate cu substanțe dizolvate mai mari decât sarea și observând efectul într-un mod mai drastic (de exemplu cu sirop de glucoză sau zahăr).
Presiunea hidrostatică pe care o exercită apa pentru a intra sau ieși se numește presiune osmotică și este reglată de concentrații și temperatură.
Ce s-ar întâmpla cu celulele noastre?
În următoarele videoclipuri puteți vedea celulele roșii din sânge într-o soluție hipertonică și într-o soluție hipotonică. Când celulele roșii din sânge se află într-o soluție hipertonică, pentru a egaliza concentrația, eliberează apă, rămânând „uscate”, ceea ce le provoacă moartea.
Când dizolvarea este hipotonă, celulele roșii din sânge tind să preia apă și să se umfle, provocând uneori ruperea celulelor sau liză.
Următoarele imagini arată rezultatul următoarei experiențe:
Celulele roșii din sânge de la aceeași persoană au fost introduse în trei soluții diferite:
- Izotonică. Eritrocitele au fost depuse într-un recipient care conține ser de sânge.
- Hipotonic Eritrocitele au fost introduse într-un recipient care conține plasmă din sânge diluat cu apă.
- Hipertonic Eritrocitele au fost plasate într-un recipient care conține plasmă de sânge la care s-a adăugat o soluție concentrată de NaCI.
- Hrișcă cu anghinare și tofu Vida en tu cocina
- Vino la dulceața de prune din bucătăria Claudian
- TAGARNINAS TORTILLA, SAU CHIMIȘTI - Bucătăria mea și alte lucruri - Chary Serrano
- Omletă franceză cu cârnați - Rețete de gătit
- Juicy hake omelette - La Cocina de Frabisa La Cocina de Frabisa