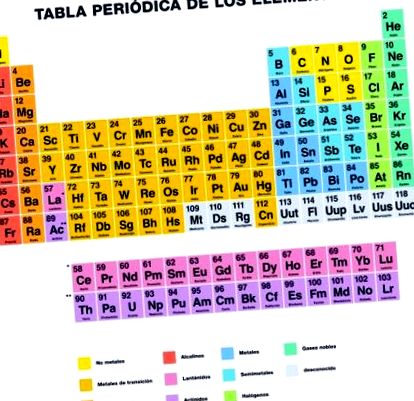
Care este tabelul periodic al elementelor?
Tabelul periodic sau tabelul periodic al elementelor este un înregistrarea organizată a elementelor chimice în funcție de numărul său atomic, proprietăți și caracteristici.
Este compus din 118 elemente confirmate de Uniunea Internațională de Chimie Pură și Aplicată (IUPAC, pentru acronimul său în limba engleză), dintre care
- 94 sunt elemente care există în natură și
- 24 de elemente sunt sintetice, adică au fost create artificial.
Dezvoltarea sa este strâns legată de descoperirea de noi elemente și de studiul proprietăților lor comune. Aspecte precum noțiunea de masă atomică și relațiile dintre masa atomică și proprietățile periodice ale elementelor au fost fundamentale pentru a configura tabelul periodic modern.
Tabelul periodic funcționează ca un instrument fundamental pentru studiul chimiei, deoarece permite identificarea într-un mod coerent și ușor a diferențelor și asemănărilor dintre elementele chimice.
Crearea sa este atribuită omului de știință rus Dimitri Mendeleev în 1869. De atunci, tabelul periodic a fost îmbunătățit și actualizat de alți oameni de știință pe măsură ce noi elemente sunt descoperite și studiate.
Cum este organizat tabelul periodic?
Tabelul periodic prezintă toate elementele cunoscute până acum, care sunt organizate și localizate în funcție de caracteristicile și relația lor între ele în grup, perioade, blocuri și metale, metaloizi și nemetalici.
Grupuri
Tabelul periodic este format din 18 grupuri de elemente organizate în coloane verticale, numerotate de la 1 la 18 de la stânga la dreapta, începând cu metalele alcaline și terminând cu gazele nobile.
Elementele care aparțin aceleiași coloane au caracteristici chimice similare, bazate pe modul în care electronii sunt structurați în ultimul strat al atomului.
De exemplu, prima coloană conține elementele care au un electron în ultima coajă a atomului. În acest caz, potasiul are patru cochilii și în ultimul are un electron.
Elementele chimice sunt organizate în grupuri după cum urmează:
- Grupa 1 (I A): metale alcaline.
- Grupa 2 (II A): metale alcalino-pământoase.
- Grupa 3 (III B): familia scandium.
- Grupa 4 (IV B): familie de titan.
- Grupa 5 (V B): familia vanadiu.
- Grupa 6 (VI B): familia cromului.
- Grupa 7 (VII B): familie de mangan.
- Grupa 8 (VIII B): familia fierului.
- Grupa 9 (VIII B): familie de cobalt.
- Grupa 10 (VIII B): familie de nichel.
- Grupa 11 (I B): familia cuprului.
- Grupa 12 (II B): familia zincului.
- Grupa 13 (III A): pământesc.
- Grupa 14 (IV A): carbonizi.
- Grupa 15 (V A): nitrogenoizi.
- Grupa 16 (VI A): calcogeni sau amfogeni.
- Grupa 17 (VII A): halogeni.
- Grupa 18 (VIII A): gaze nobile.
Perioade
Perioadele sunt cele șapte rânduri orizontale pe care le are tabelul periodic. În aceste rânduri sunt grupate elementele care au numărul de cochilii de electroni care coincid cu numărul perioadei.
De exemplu, în primul rând hidrogenul și heliul au o coajă de electroni. În perioada a doua există opt elemente care au două cochilii de electroni. În al treilea rând, elementele au trei cochilii de electroni și așa mai departe.
În perioada șase sunt elementele care au șase cochilii de electroni, precum rândul de jos al lantanidelor. În perioada șapte sunt elementele care au șapte cochilii de electroni, precum și ultimul rând de actinide.
Metale, metaloizi și nemetale
Trei categorii de elemente care alcătuiesc tabelul periodic pot fi diferențiate de proprietățile lor chimice și fizice, care sunt: metale, metaloizi și nemetale.
- Metale: sunt elemente solide la temperatura camerei, minus mercurul care se află în stare lichidă. Sunt maleabile și ductile și sunt buni conductori de căldură și electricitate. Se găsesc în partea stângă a mesei.
- Fără metale: Sunt în mare parte gaze, deși există și lichide. Aceste elemente nu sunt buni conductori de electricitate. Sunt în partea dreaptă a mesei.
- Metaloizi sau semi-metale: au proprietăți atât ale metalelor, cât și ale nemetalelor. Ele pot fi strălucitoare, opace și nu foarte ductile. Conductivitatea sa electrică este mai mică decât metalele, dar mai mare decât nemetalele. Se găsesc în partea dreaptă a mesei, între metale și nemetale.
Blocuri
Tabelul periodic poate fi, de asemenea, împărțit în patru blocuri pe baza secvenței cochiliilor de electroni a fiecărui element. Numele fiecărui bloc derivă în funcție de orbitalul în care se află ultimul electron.
- Blocul s: grupurile 1 și 2 ale metalelor alcaline, metalelor alcalino-pământoase, hidrogenului și heliului.
- Blocul p: acoperă grupurile 13-18 și metaloizi.
- Blocul d: compus din grupele 3-12 și metale de tranziție.
- Blocul f: nu are număr de grup și corespunde lantanidelor și actinidelor. În general, acestea sunt plasate sub tabelul periodic.
Tendințele tabelului periodic
Tendințele periodice se referă la principalele proprietăți fizice și chimice pe care le au elementele și care permit organizarea lor în tabelul periodic. Aceste tendințe sunt legate de schimbările care apar în structura atomică a fiecărui element în funcție de perioada sau grupul căruia îi aparține.
Printre tendințele periodice se numără:
Date de bază ale elementelor chimice
Tabelele periodice conțin de obicei date fundamentale ale fiecăruia dintre elementele existente în acesta, ceea ce permite stabilirea unei organizări coerente bazate pe caracteristicile sale, cum ar fi simbolul, numele, numărul atomic și masa atomică, pentru a determina utilizarea acestuia.
- Masă atomică: se referă la masa atomului, compusă din protoni și neutroni.
- Energie de ionizare: este energia necesară pentru a separa un electron de atom.
- Simbol chimic: abrevieri pentru identificarea elementului chimic.
- Nume: denumire dată elementului chimic, poate fi derivat din latină, engleză, franceză, germană sau rusă.
- Configurare electronică: modul în care electronii sunt structurați sau organizați într-un atom.
- Numar atomic: se referă la numărul total de protoni pe care îi are un atom.
- Electronegativitate: este capacitatea unui atom de a atrage electroni spre sine.
- Stări de oxidare: indicator al gradului de oxidare al unui atom care face parte dintr-un element chimic compus.
Pentru ce este tabelul periodic?
Tabelul periodic este foarte util pentru studiile științifice, având în vedere diferitele funcții pe care le are.
- Permite identificarea diferențelor și asemănărilor dintre diferitele elemente. De exemplu, conține informații valoroase, cum ar fi masa atomică a fiecărui element.
- Face posibilă analiza comportamentului chimic al elementelor. De exemplu, când distingem electronegativitatea și configurația electronică a elementului.
- Acesta servește ca instrument fundamental pentru studiul chimiei, inclusiv a biologiei și a altor ramuri ale științei, deoarece identifică principalele caracteristici ale elementelor chimice.
- Face ușoară distincția elementelor de numărul lor atomic. Acest lucru se datorează faptului că elementele sunt compuse din atomi, care își primesc numele și se diferențiază prin numărul de protoni, electroni și neutroni pe care îl conține.
- Poate fi folosit pentru a prezice proprietățile chimice ale noilor elemente care urmează să fie incluse în tabel, ținând seama de caracteristicile elementelor deja definite.
Istoria tabelului periodic
Crearea tabelului periodic este atribuită omului de știință rus Dmitri Mendeleev, care în 1869 a adunat într-un tabel cele 63 de elemente cunoscute până acum de știință.
Mendeleev a organizat elementele în ordine crescătoare după masele lor atomice, având grijă să plaseze în aceeași coloană pe acelea ale căror proprietăți fizice sunt similare. El a lăsat chiar spații goale anticipând existența altor elemente nedescoperite încă la acea vreme și care ar trebui incluse în tabel.
La scurt timp, chimistul german Julius Lothar Meyer a aranjat elementele pe baza proprietăților fizice ale atomilor. În cele din urmă, structura sa actuală se datorează omului de știință elvețian Alfred Werner.
Ultimele modificări majore din tabelul periodic sunt lucrările câștigătorului Premiului Nobel pentru chimie Glenn Seaborg, care, printre altele, a comandat seria actinidelor de sub seria lantanidelor.
- Telehealth Ce este, cum se pregătește, este acoperit Institutul Național pentru Îmbătrânire
- Cum să știu dacă câinele meu este la greutatea sa ideală
- Smooth-ul tău te îngrașă Știm cum să-l evităm
- Surimi, din ce este făcut, cum este făcut și ce contribuie la corp?
- Ce minerale se pierd în transpirație și cum să le înlocuiască Supradyn®, complex vitaminic