rezumat
Acces furnizat de
Principal
Limitările majore ale vectorilor virali, în special cele legate de siguranță și imunogenitate, au condus studii pentru a îmbunătăți metodele de livrare a genelor non-virale. 1 Printre astfel de vectori non-virali, lipozomii cationici sunt unul dintre cele mai promițătoare sisteme non-virale pentru utilizare în terapia genică. 2 Livrarea eficientă a genelor terapeutice funcționale în celulele țintă este o problemă majoră în abordările de terapie genetică pentru tratamentul cancerului și a bolilor metabolice, precum și a infecției cu virusul imunodeficienței umane.
Presupunem că interacțiunea electrostatică a lipozomilor SG cationici cu ADN nu a fost suficientă pentru a permite formarea unui complex lipozom/ADN cu o dimensiune mică a particulelor. Prin urmare, am proiectat lipozomi de dimensiuni mici cu încărcare pozitivă care, după amestecarea cu o fază apoasă care conține ADN, pot fi încărcați cu ADN, rezultând formarea unui complex lipozom/ADN mic. Pentru selecția ficatului, pregătim lipozomi care conțin β-sitosterol β-D-glucozid (Sit-G), care este componenta principală a SG (lipozomi Sit-G). Pentru a crește încărcătura pozitivă în lipozomi, am selectat reactivul Tfx-20 (Tfx) și 3β [N - (N ', N' -dimetilaminoetan) -carbamoil] colesterol (DC-Chol) ca lipide cationice, deoarece primul este compus lipidic cationic sintetic [[N, N, N ', N' -tetrametil- N, N '-bis (2-hidroxietil) -2, 3-di (oleoiloxi) -1,4-iodură de butanediamoniu] care conduce la niveluri ridicate Eficiența transfecției în liniile celulare 13 și aceasta din urmă a fost deja utilizată clinic pentru terapia genică. 14, 15 Pentru a prepara lipozomi mici, folosim metoda modificată de injectare a etanolului.
În acest studiu, pregătim lipozomi Sit-G mici încărcați pozitiv, optimizăm raportul dintre ADN-ul plasmidic care codifică gena reporterului luciferazei și lipozomii Sit-G prin evaluarea eficienței transfecției în celulele HepG2 în prezența serului în mediu și a investigat expresia genică a complexului ADN/lipozom Sit-G după injecție intravenoasă la șoareci.
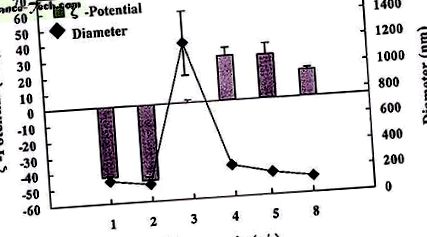
Lipozomii Sit-G (78 ± 2 nm) cu un potențial ridicat de 0,8 pozitiv (33,8 ± 7,0 mV) s-au dovedit a avea o formă rotundă prin observare microscopică (datele nu sunt prezentate). Suspensia de lipozomi Sit-G a fost foarte stabilă și a putut fi păstrată câteva luni la 4 ° C fără nicio modificare a dimensiunii particulelor (datele nu sunt prezentate). Mărimea particulei și potențialul complexelor de lipozomi/ADN Sit-G depindeau de raportul de încărcare (+/-) al lipidei cationice la ADN (Figura 1). Cu un raport de încărcare (+/-) de aproximativ 3, cea mai mare dimensiune medie a particulei și varianța complexului (1200 ± 247 nm) au fost observate atunci când abordarea potențială s-a apropiat de aproximativ zero (0,1 ± 0,3 mV). Cu excepția unui raport de încărcare de 3, dimensiunea particulelor complexului lipozom/ADN a fost în intervalul de aproximativ 100-250 nm.
Imagine la dimensiune completă
Pentru a optimiza raportul dintre ADN și lipozomii Sit-G, expresia genei raportoare a fost investigată în celulele HepG2 transfectate cu lipozomi Sit-G la diferite rapoarte de încărcare (+/-) în mediu cu sau fără ser (Figura 2). Raportul de încărcare (+/−) asociat cu eficiența mai mare a transfecției complexului lipozom Sit-G/ADN a fost modificat de la 3 la 4 prin adăugarea de 10% ser la mediu. După incubare timp de 1 oră în mediu conținând ser, dimensiunea particulelor complexului lipozom/ADN Sit-G la un raport de încărcare (+/−) de 4 a crescut de la 240 ± 16 nm la aproximativ 3 μm, iar potențialul de a scăzut de la 27,9 ± 5,1 mV până la −8,9 ± 2,1 mV. Diverse componente ale serului, cum ar fi albumina serică bovină (BSA), heparina, imunoglobulina G și lipoproteinele modifică potențialul complexului lipozom/ADN de la pozitiv la negativ sau neutru. 16, 17 Prin urmare, complexul lipozom/ADN din mediul care conține ser ar putea necesita o sarcină pozitivă în exces, rezultând o creștere a raportului de încărcare (+/-) pentru o eficiență ridicată a transfecției de 3 până la 4.
Expresia genelor în celulele HepG2 transfectate cu lipozomi Sit-G, lipozomi non-Sit-G sau complexe Tfx/ADN în mediu cu sau fără 10% ser. Alicote de 2 ug de ADN plasmidic (pAAV-CMV-luc) au fost complexate cu fiecare tip de lipozom sau particule Tfx la raporturi de încărcare (+/-) de 4 și respectiv 2 pe godeu. Complexele Tfx/ADN au fost preparate ca martori cu și fără ADN la un raport de încărcare (+/-) de 2 (2 μg de ADN cu 0,06 mg/ml lipide totale, respectiv 0,015 mg/ml lipide cationice, respectiv), producătorii. Protocol (Promega). Lipozomii non-Sit-G compuși din Tfx/DC-Chol (1,3/2, raport în greutate) au fost preparați prin metoda modificată de injectare a etanolului, așa cum este descris în legenda din Figura 1. Alte condiții experimentale au fost identice cu cele descrise în legenda Figura 2. Fiecare coloană reprezintă media ± SD (n = 3). *** P
Dependența de doză a expresiei genice la 24 de ore după injectarea intravenoasă a lipozomului Sit-G complexat cu ADN plasmidic la șoareci. Raportul de încărcare (+/-) al lipidei cationice la ADN-ul plasmidic (pAAV-CMV-luc) a fost de 4. Protocolul experimental a fost identic cu cel descris în legenda din Figura 4. Fiecare coloană reprezintă media ± SD (n = 4 ). (□) 30 ug de ADN; (▪) 50 µg de ADN; (░) 100 μg ADN.
Imagine la dimensiune completă
Lipozomii Sit-G par a fi vectori potențial utili pentru țintirea ficatului care arată o eficacitate similară cu cea a ligandului galactozilic, deși este necesar să se clarifice dacă expresia genică în ficat este selectivă pentru celulele parenchimatoase sau non-parenchimatice. La douăzeci și patru de ore după injectarea intravenoasă a unui complex lipozom/ADN non-Sit-G la o doză de 50 µg ADN, unul dintre cei cinci șoareci a murit. Acest lucru s-ar putea datora toxicității cauzate de agregatele complexului din ser, după cum sugerează observația că complexul lipozom non-Sit-G/ADN era mai mare decât complexul lipozom Sit-G/ADN în mediu care conține ser (Figura 6 ). Această constatare a sugerat că adăugarea Sit-G la lipozomi ar putea duce la o bună dispersie a complexului lipozom/ADN în ser.
Micrografii electronice de scanare ale complexelor ADN/lipozomi Sit-G (a) și complexe ADN/lipozomi non-Sit-G (b) după incubare timp de 1 oră cu mediu seric 10%. Raportul de încărcare (+/-) al lipidei cationice din lipozomi la ADN-ul plasmidic (pAAV-CMV-luc) a fost de 4. ADN-ul plasmidic (2 µg) a fost amestecat și incubat timp de 15 minute la temperatura camerei cu lipozomii în apă și apoi pentru 1 h în mediu cu 10% ser la 37 ° C. Metoda utilizată pentru a vizualiza complexele lipozom/ADN a fost adaptată de la Sternberg și colab. Pe scurt, 10 pl alicote de probe proaspăt preparate au fost plasate pe platforma de cupru și acoperite cu o lamă de acoperire, pe care s-a format un singur strat de complex lipozom/ADN. Stratul a fost înghețat și uscat. După îndepărtarea lamelei de acoperire, stratul complex lipozom/ADN de pe platforma de cupru a fost acoperit cu aur și vizualizat cu un microscop electronic cu scanare (SEM) (JSM-T200; JEOL, Tokyo, Japonia).
Imagine la dimensiune completă
În concluzie, am pregătit cu succes mici complexe Sit-G-lipozom/ADN cu un diametru de aproximativ 200 nm la pH 7 pentru eliberarea genelor care vizează ficatul. Complexul lipozom Sit-G/ADN a crescut semnificativ eficiența transfecției în celulele HepG2 la un raport de încărcare (+/-) de 4 cu adăugarea de 10% ser la mediu, indicând expresia genei selective în ficat după injectarea intravenoasă la șoareci, sugerând că interacțiunea complexelor lipozom/ADN cu serul poate fi un punct cheie în prezicerea eficacității in vivo a unui vector lipozom.
Lipozomii Sit-G vor fi utili ca vectori pentru eliberarea genelor hepatice prin îmbunătățiri suplimentare, cum ar fi adăugarea de peptidă fusogenă la lipozom pentru a crește eliberarea de ADN complex în citosol și optimizarea condițiilor pentru formarea complexă. Și doza de lipide.
Expresii de recunoștință
Dorim să mulțumim profesorului T Tsuji și grupului său de cercetare din cadrul Departamentului de Microbiologie de la Universitatea Hoshi pentru asistența lor în prepararea plasmidelor și profesorului asociat J Kamei și grupului său de cercetare din cadrul Departamentului de farmacologie de la Universitatea din Hoshi pentru asistența sa testul luciferazei. De asemenea, dorim să îi mulțumim dr. J Wang pentru asistență în munca experimentală. Această lucrare a fost susținută parțial de Fundația Tokyo Nagai și de un grant de cercetare științifică acordat de Ministerul Educației, Științei, Sportului și Culturii, Japonia, 12672210.
- Sănătatea ficatului cu GIST - Un ficat viu - Grupul Life Raft
- Ce să mănânci dacă ai ficat gras
- Vânzare de viagra în farmacii - Prețuri mărci Viagra online
- Tabel de puncte online
- Livrare gratuită Tricor - Cumpărați fenofibrat online ieftin