2.1: Idei timpurii în teoria atomică
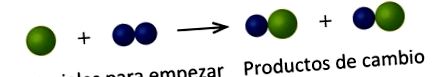
În următorul desen, sferele verzi reprezintă atomii unui anumit element. Sferele albastre reprezintă atomii unui alt element. Dacă sferele diferitelor elemente se ating, ele fac parte dintr-o singură unitate a unui compus. Următoarea modificare chimică reprezentată de aceste sfere poate încălca una dintre ideile teoriei atomice a lui Dalton. Care?
Materialele de pornire constau dintr-o sferă verde și două sfere albastre. Produsele constau din două sfere verzi și două sfere albastre. Acest lucru încalcă postulatul lui Dalton că atomii nu sunt creați în timpul unei schimbări chimice, ci sunt pur și simplu redistribuiți.
Care postulat al teoriei lui Dalton este în concordanță cu următoarea observație cu privire la greutățile reactanților și produselor? Când se încălzesc 100 de grame de carbonat de calciu solid, se produc 44 de grame de dioxid de carbon și 56 de grame de oxid de calciu.
Identificați postulatul teoriei lui Dalton care este încălcat de următoarele observații: 59,95% dintr-o probă de dioxid de titan este titan; 60,10% dintr-o probă diferită de dioxid de titan este titan.
Această afirmație încalcă al patrulea postulat al lui Dalton: într-un compus dat, numărul atomilor de fiecare tip (și, prin urmare, și procentul) au întotdeauna același raport.
Sunt analizate probele de compus X, Y și Z, cu rezultatele prezentate aici.
| X | Lichid limpede, incolor, cu miros puternic. | 1.776 g | 0,148 g |
| Da | Lichid limpede, incolor, cu miros puternic. | 1.974 g | 0,329 g |
| Z | Lichid limpede, incolor, cu miros puternic. | 7,812 g | 0,651 g |
Aceste date oferă exemplul (ele) legii proporțiilor definite, legea proporțiilor multiple, a uneia sau a ambelor? Ce vă spun aceste fapte despre compușii X, Y și Z?
2.2: Evoluția teoriei atomice
Instruire
- Existența izotopilor încalcă una dintre ideile originale ale teoriei atomice a lui Dalton. Care?
- Cum sunt electronii și protonii la fel? Care este diferența dintre ele?
- Cum sunt protonii și neutronii la fel? Care este diferența dintre ele?
- Preziceți și testați comportamentul particulelor α aruncate împotriva unui atom model de „budincă de prune”.
- Preziceți căile parcurse de particulele α care sunt arse spre atomi cu structura modelului de budincă de prune Thomson. Explicați de ce vă așteptați ca particulele α să ia aceste căi.
- Dacă particulele α cu energie mai mare decât cele din (a) sunt arse asupra atomilor de budincă de prune, preziceți modul în care traseele lor vor diferi de traseele particulelor α cu energie mai mică. Explicați-vă raționamentul.
- Acum testați predicțiile despre (a) și (b). Deschide Simulare de împrăștiere Rutherford și selectați fila „Atom de budincă de prune”. Setați „Energia particulelor alfa” la „min” și selectați „arată urmele”. Faceți clic pe pistol pentru a începe să trageți particule α. Se potrivește acest lucru cu predicția dvs. de la (a)? Dacă nu, explicați de ce ruta reală ar fi cea prezentată în simulare. Apăsați butonul de pauză sau „Resetați toate”. Setați „Energia particulelor alfa” la „max” și începeți să fotografiați particule α. Se potrivește acest lucru cu predicția dvs. de la (b)? Dacă nu, explicați efectul creșterii energiei asupra rutelor reale așa cum se arată în simulare.
- Preziceți și testați comportamentul particulelor α arse într-un model de atom Rutherford.
- (a) Preziceți căile parcurse de particulele α care sunt arse asupra atomilor cu o structură a modelului atomului Rutherford. Explicați de ce vă așteptați ca particulele α să ia aceste căi.
- (b) Dacă particulele α de energie mai mare decât cele din (a) sunt arse asupra atomilor de la Rutherford, prezice modul în care traiectoria lor va diferi de traiectoria particulelor α cu energie inferioară. Explicați-vă raționamentul.
- (c) Preziceți modul în care vor lua traseele particulelor α dacă atomii Rutherford de elemente, altele decât aurul, sunt arși. Ce factor sperați că va provoca această diferență pe drumuri și de ce?
- (d) Acum testați predicțiile despre (a), (b) și (c). Deschide Simulare de împrăștiere Rutherford și selectați fila „Rutherford Atom”. Datorită dimensiunii simulării, cel mai bine este să începeți cu un nucleu mic, așa că selectați „20” pentru protoni și neutroni, „min” pentru energie, arătați urmele și apoi începeți să trageți particule α. Se potrivește acest lucru cu predicția dvs. de la (a)? Dacă nu, explicați de ce ruta reală ar fi cea prezentată în simulare. Întrerupeți sau reporniți, setați energia la „max” și începeți să aruncați particule α. Se potrivește acest lucru cu predicția dvs. de la (b)? Dacă nu, explicați efectul creșterii energiei asupra traseului real așa cum se arată în simulare. Întrerupeți sau reporniți, selectați „40” pentru protoni și neutroni, „min” pentru energie, arătați urmele și trageți. Se potrivește acest lucru cu predicția dvs. de la (c)? Dacă nu, explicați de ce ruta reală ar fi cea prezentată în simulare. Repetați acest lucru cu un număr mai mare de protoni și neutroni. Ce generalizare puteți face despre tipul de atom și efectul asupra traseului particulelor α? Fii clar și specific în răspunsul tău.
Soluții
1 Dalton a crezut inițial că toți atomii unui anumit element au proprietăți identice, inclusiv masa. Prin urmare, conceptul de izotopi, în care un element are mase diferite, a constituit o încălcare a ideii originale. Pentru a explica existența izotopilor, al doilea postulat al teoriei sale atomice a fost modificat pentru a afirma că atomii aceluiași element trebuie să aibă proprietăți chimice identice.
2 Ambele sunt particule subatomice care locuiesc în nucleul unui atom. Amândoi au aproximativ aceeași masă. Protonii sunt încărcați pozitiv, în timp ce neutronii sunt neîncărcați.
3 Ambele sunt particule subatomice care locuiesc în nucleul unui atom. Amândoi au aproximativ aceeași masă. Protonii sunt încărcați pozitiv, în timp ce neutronii sunt neîncărcați.
4. (a) Modelul de budincă de prune indică faptul că încărcătura pozitivă este uniform distribuită în tot atomul, așa că ne așteptăm ca particulele α (poate) să fie reduse puțin prin repulsia pozitiv-pozitivă, dar să urmeze căi în linie dreaptă (adică să nu fie deviat) pe măsură ce trec prin atomi. (b) Particulele α cu energie mai mare vor călători mai repede (și poate încetini) și vor urma, de asemenea, căi drepte prin atomi. (c) Particulele α au urmat linii drepte prin atomul de budincă de prune. Nu a existat nicio scădere aparentă a particulelor α pe măsură ce treceau prin atomi.
5. (a) Atomul Rutherford are un nucleu mic, încărcat pozitiv, astfel încât majoritatea particulelor α vor trece prin spațiul gol departe de nucleu și nu vor fi deviate. Particulele α care trec aproape de nucleu se vor abate de la căile lor din cauza repulsiei pozitive-pozitive. Cu cât particulele α sunt direcționate mai direct spre nucleu, cu atât este mai mare unghiul de deviere. (b) Particulele α de energie mai mare care trec aproape de nucleu vor continua să fie deviate, dar cu cât se deplasează mai repede, unghiul de deviere va fi mai mic decât se aștepta. (c) În cazul în care nucleul este mai mic, sarcina pozitivă este mai mică și deviațiile așteptate sunt mai mici, atât în ceea ce privește cât de aproape trec particulele α prin nucleu fără deviere și unghiul de deviere. Dacă nucleul este mai mare, sarcina pozitivă este mai mare și deviațiile așteptate sunt mai mari: vor fi deviate mai multe particule α, iar unghiurile de deviere vor fi mai mari. (d) Căile urmate de particulele α coincid cu predicțiile lui (a), (b) și (c).
2.3: Structura atomică și simbolism
În ce mod diferă întotdeauna izotopii unui element dat? În ce fel (ele) sunt întotdeauna la fel?
Scrieți simbolul pentru fiecare dintre următorii ioni:
- (a) ionul cu o sarcină de 1+, numărul atomic 55 și numărul de masă 133
- (b) ionul cu 54 de electroni, 53 de protoni și 74 de neutroni
- (c) ionul cu numărul atomic 15, masa numărul 31 și o sarcină de 3
- (d) ionul cu 24 de electroni, 30 de neutroni și o sarcină de 3+
(a) 133 Cs +; (b) 127 I -; (c) 31 P 3-; (d) 57 Co 3+
Scrieți simbolul pentru fiecare dintre următorii ioni:
- (a) ionul cu o sarcină de 3+, 28 de electroni și un număr de masă de 71
- (b) ionul cu 36 de electroni, 35 de protoni și 45 de neutroni
- (c) ionul cu 86 de electroni, 142 de neutroni și o sarcină de 4+
- (d) ionul cu o sarcină de 2+, numărul atomic 38 și numărul de masă 87
Deschideți simularea construiți un atom și faceți clic pe pictograma atom.
- (a) Alegeți oricare dintre primele 10 elemente pe care doriți să le construiți și indicați simbolul acestuia.
- (b) Trageți protoni, neutroni și electroni pe șablonul atomului pentru a forma un atom al elementului său. Indicați numărul de protoni, neutroni și electroni din atomul dvs., de asemenea, indicați sarcina netă și numărul de masă.
- (c) Faceți clic pe „Încărcare netă” și „Număr masă”, verificați răspunsurile la litera (b) și corectați, dacă este necesar.
- (d) Preziceți dacă atomul dvs. va fi stabil sau instabil. Vă rugăm să vă expuneți raționamentul.
- (e) Bifați caseta „Stabil/Instabil”. A fost corect răspunsul dvs. la (d)? Dacă nu, preziceți mai întâi ce puteți face pentru a crea un atom stabil al elementului dvs., apoi continuați și vedeți dacă funcționează. Explicați-vă raționamentul.
(a) Carbon-12, 12 C; (b) Acest atom conține șase protoni și șase neutroni. Există șase electroni într-un atom neutru de 12 C. Încărcarea netă pe acest atom neutru este zero, iar numărul de masă este 12. (c) Răspunsurile de mai sus sunt corecte. (d) Atomul va fi stabil deoarece C-12 este un izotop stabil al carbonului. (e) Răspunsul anterior este corect. Alte răspunsuri pentru acest exercițiu sunt posibile dacă se alege un element diferit al izotopului.
(a) Trageți protoni, neutroni și electroni pe șablonul atomului pentru a crea un atom neutru de oxigen-16 și pentru a da simbolul izotopic pentru acest atom.
(b) Acum adăugați încă doi electroni pentru a forma un ion și dați simbolul pentru ionul pe care l-ați făcut.
(a) Trageți protoni, neutroni și electroni pe șablonul atomului pentru a face un atom de litiu-6 neutru și pentru a da simbolul izotopului acestui atom.
(b) Acum îndepărtați un electron pentru a forma un ion și dați simbolul pentru ionul pe care l-ați făcut.
(a) Litiu-6 conține trei protoni, trei neutroni și trei electroni. Simbolul izotopului este 6 Li sau \ (\ ce<^6_3Li>\). (b) 6 Li + o \ (\ ce<^6_3Li+>\)
Determinați numărul de protoni, neutroni și electroni din următorii izotopi utilizați în diagnosticele medicale:
(a) numărul atomic 9, masa numărul 18, sarcina de 1−
(b) numărul atomic 43, masa numărul 99, sarcina de 7+
(c) numărul atomic 53, masa atomică numărul 131, sarcina de 1−
(d) numărul atomic 81, masa atomică numărul 201, sarcina de 1+
(e) Denumiți elementele din părțile (a), (b), (c) și (d).
Următoarele sunt proprietățile izotopilor a două elemente esențiale în dieta noastră. Determinați numărul de protoni, neutroni și electroni din fiecare și denumiți-i.
(a) numărul atomic 26, masa numărul 58, sarcina de 2+
(b) numărul atomic 53, masa numărul 127, sarcina de 1−
(a) Fier, 26 de protoni, 24 de electroni și 32 de neutroni; (b) iod, 53 de protoni, 54 de electroni și 74 de neutroni
Indicați numărul de protoni, electroni și neutroni din atomii neutri ai fiecăruia dintre următorii izotopi:
Indicați numărul de protoni, electroni și neutroni din atomii neutri ai fiecăruia dintre următorii izotopi:
(a) 3 protoni, 3 electroni, 4 neutroni; (b) 52 de protoni, 52 de electroni, 73 de neutroni; (c) 47 de protoni, 47 de electroni, 62 de neutroni; (d) 7 protoni, 7 electroni, 8 neutroni; (e) 15 protoni, 15 electroni, 16 neutroni
Faceți clic pe site și selectați fila „amestecați izotopi”, ascundeți casetele „compoziție procentuală” și „masă atomică medie”, apoi selectați elementul bor.
(a) Scrieți simbolurile pentru izotopii borului prezentate ca fiind naturale în cantități semnificative.
(b) Preziceți cantitățile relative (procente) ale acestor izotopi de bor găsite în natură. Explicați raționamentul din spatele alegerii dvs.
(c) Adăugați izotopi în caseta neagră pentru a face un amestec care se potrivește cu predicția dvs. în (b). Puteți să trageți izotopi din tăvile lor sau să dați clic pe „Mai multe” și apoi să mutați glisoarele la cantitățile corespunzătoare.
(d) Dezvăluie casetele „Compoziție procentuală” și „Masă atomică medie”. Cât de bine se potrivește amestecul cu predicția ta? Dacă este necesar, reglați cantitățile de izotop pentru a se potrivi cu predicția dvs.
(e) Selectați amestecul de izotopi din „Natura” și comparați-l cu predicția dvs. Cât de bine se compară predicția dvs. cu mixul natural? Explica. Dacă este necesar, ajustați sumele pentru a se potrivi cu sumele „Natura” cât mai aproape posibil.
Repetați exercițiu folosind un element care are trei izotopi naturali.
Să folosim neonul ca exemplu. Neonul are trei izotopi și nu există nicio modalitate de a fi sigur de a prezice cu precizie abundențele pentru a face un total de 20,18 amu de masă atomică medie. Să presupunem că abundențele sunt 9% Ne-22, 91% Ne-20 și doar o urmă de Ne-21. Masa medie ar fi de 20,18 amu. Verificarea amestecului natural de izotopi arată că abundențele sunt de 90,48% Ne-20, 9,25% Ne-22 și 0,27% Ne-21, deci estimările noastre trebuie ajustate puțin.
Un element are următoarele abundențe naturale și mase izotopice: 90,92% abundență cu 19,99 amu, 0,26% abundență cu 20,99 amu și 8,82% abundență cu 21,99 amu. Calculați masa atomică medie a acestui element.
Masele atomice medii enumerate de IUPAC se bazează pe un studiu al rezultatelor experimentale. Bromul are doi izotopi 79 Br și 81 Br, ale căror mase (78,9183 și 80,9163 amu) și abundențe (50,69% și 49,31%) au fost determinate în experimentele anterioare. Calculați masa atomică medie a bromului pe baza acestor experimente.
Variații ale masei atomice medii pot fi observate pentru elementele obținute din diferite surse. Litiul este un exemplu în acest sens. Compoziția izotopică a litiului din minerale naturale este de 7,5% 6 Li și 92,5% 7 Li, care au mase de 6,01512 amu, respectiv 7,01600 amu. O sursă comercială de litiu, reciclată dintr-o sursă militară, a fost de 3,75% 6 Li (iar restul de 7 Li). Calculați valorile medii ale masei atomice pentru fiecare dintre aceste două surse.
Masele atomice medii ale unor elemente pot varia, în funcție de sursele de minerale ale acestora. Borul natural este format din doi izotopi cu mase cunoscute cu precizie (10 B, 10.0129 amu și 11 B, 11.0931 amu). Masa atomică efectivă a borului poate varia de la 10.807 la 10.819, în funcție de sursa minerală din Turcia sau Statele Unite. Calculați procentul de abundență care duce la cele două valori ale masei atomice medii de bor pentru aceste două țări.
Sursă Turcia: 0,2649 (din 10.0129 izotop amu); Sursa SUA: 0,2537 (de la izotopul 10.0129 amu)
Raportul de abundență 18 O: 16 O în unele meteoriți este mai mare decât cel folosit pentru a calcula masa atomică medie de oxigen pe pământ. Masa medie a unui atom de oxigen din acești meteoriți este mai mare, mai mică sau egală cu cea a unui atom de oxigen terestru?
2.4: Formule chimice
Explicați de ce simbolul unui atom al elementului oxigen și formula pentru o moleculă de oxigen sunt diferite.
Simbolul pentru elementul oxigen, O, reprezintă atât elementul cât și un atom de oxigen. O moleculă de oxigen, O2, conține doi atomi de oxigen; Indicele 2 din formulă trebuie utilizat pentru a distinge molecula diatomică de doi atomi de oxigen individuali.
Explicați de ce simbolul elementului sulf și formula pentru o moleculă de sulf sunt diferite.
Scrieți formulele moleculare și empirice pentru următorii compuși:
- Ce exerciții să fac dacă sunt supraponderal
- Ce exerciții de făcut pentru a reduce burta în 2018 🏆
- Ce exerciții pot face pentru a-mi slăbi picioarele acasă
- Ce salate de fructe să mănânce înainte sau după antrenament Exerciții nutriționale Dieta de fitness
- Ce exerciții, pol și alte activități fizice faceți, cât de des? Ce tipuri de