Subiecte
rezumat
Introducere
Rezultate
Gas2/HSP90/HSP40 au format un complex proteic legat de caspază-3 în celulele cu suspensie de orez sub stres termic
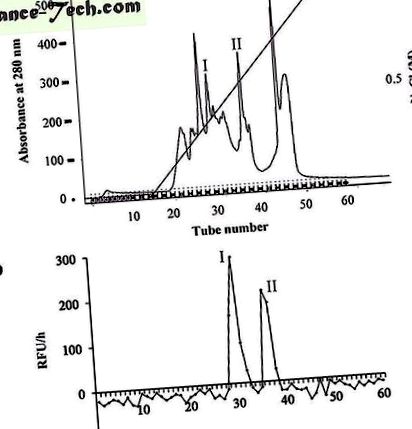
( la ) Fracțiile active de caspază-3 din coloana G-75 au fost reunite și purificate în continuare pe o coloană Mono-Q echilibrată cu tampon Tris/HCI 20 mM, pH 8,0. Proteinele au fost eluate cu un gradient de NaCl (0
1 M) într-un tampon Tris/HCI 20 mM, pH 8,0, la un debit de 1 ml/min. Proteinele au fost detectate prin absorbanță la 280 nm. Vârfurile au fost colectate, respectiv. ( b ) Un număr egal de vârfuri colectate din coloana Mono-Q au fost incubate cu Ac-DEVD-AMC. Fluorescența AMC a fost măsurată de un cititor de microplăci la 30 ° C. RFU/oră a reprezentat diferențele relative ale unității de fluorescență produse în 1 oră. I și II reprezintă vârfurile care au prezentat activitate asemănătoare caspazei-3.
Imagine la dimensiune completă
Masă completă
Profilul de exprimare Gas2 sub diferite tensiuni.
În condiții fiziologice, Gas2 este o subunitate necatalitică a glucozidazei II, care participă la glicozilarea proteinelor din ER. Pentru a identifica funcțiile biologice ale Gas2 sub stres abiotic, expresia Gas2 a fost măsurată printr-o reacție în lanț cantitativă în timp real a polimerazei în diferite condiții, chiar și sub stres ER indus de DTT. Tratamentul cu DTT de 6,4 mM a indus expresia Os bZIP50 34, gena marker pentru UPR, care a indicat faptul că DTT a fost capabil să inducă stresul ER în celulele din suspensia de orez (Fig. 2a) și, în aceste condiții, Gas2 a fost reglementat în jos ( Fig. 2b). În plus față de stresul ER, Gas2 a fost, de asemenea, reglat în jos sub diferite tensiuni abiotice, cum ar fi stresul rece (Fig. 2c), osmotic (Fig. 2d) și sare (Fig. 2e).
( la ) DTT a indus expresia OsbZIP50 în linii celulare de tip sălbatic și OsGas2 RNAi. Protoplastele au fost preparate din celule în suspensie și tratate cu 6,4 mM DTT timp de 18 ore la 26-28 ° C. ( b ) Exprimarea OsGAS2 în protoplastele celulelor în suspensie cu tratamentul DTT 6,4 mM pentru momente diferite. ( c - e ) Exprimarea OsGAS2 în rădăcinile răsadurilor de 8 zile cu tratamentul la 4 ° C ( c ), 150 mM NaCI ( d ) și 40% din PEG 6000 ( și ) pentru momente diferite. ARN total a fost izolat pentru RT-PCR și experimentele au fost repetate de trei ori.
Imagine la dimensiune completă
Localizarea subcelulară
Deoarece Gas2 formează un complex proteic legat de caspază-3 cu GRP94 și HSP40 care conțin TPR, a fost examinată localizarea subcelulară a acestor trei proteine. Așa cum era de așteptat, Gas2 și GRP94 au fost localizate în ER (Fig. 3a, b), în timp ce HSP40 conținând TPR a fost localizat în citoplasmă (Fig. 3c). Deoarece activitatea citpazei-3 a fost prezentă în citoplasmă, acest lucru a sugerat că, în condiții specifice de stres, HSP40 care conține TPR poate forma un complex cu Gas2 și GRP94 la interfața citoplasmei ER, deoarece se știe că ER oferă situri de legare multe proteine citosolice.
Construcțiile care poartă 35S: Grp94-GFP, 35S: GAS2-GFP și 35S: GFA2-GFP, au fost introduse respectiv în protoplaste din tulpinile răsadurilor de orez prin transformare mediată de PEG-calciu. Fluorescența GFP a fost observată după 16 ore de incubare cu un microscop confocal PerkinElmer UltraVIEW VoX. ER-Tracker ™ albastru-alb DPX (E12353) a fost utilizat ca control de localizare ER. Experimentele au fost repetate de cel puțin cinci ori. Bară = 5 μm.
Imagine la dimensiune completă
Reglarea în jos a autofagiei induse de Gas2 în celulele cu suspensie de orez
Imagine la dimensiune completă
Gas2 este un nou substrat pentru activitatea caspazei-3 în orez.
( la ) Eticheta sa 6 a fost fuzionată în capătul N-terminal al OsGAS2 și mutantul D110A/D113A, iar proteina de fuziune a fost exprimată în E. coli. Proteinele mutante purificate de tip sălbatic și 6 marcate cu His au fost incubate respectiv cu tampon de reacție, caspază-3 și facțiune citosolică a celulelor de suspensie de orez tratate termic. După incubare, produsele de reacție au fost analizate cu 12,5% SDS-PAGE, urmat de imunoblotare cu un anticorp anti-poli histidină care a recunoscut epitopul OsGAS2 N-terminal marcat cu His 6. Săgețile indică benzile proteice țintă. ( b ) Schema pentru fragmentarea OsGas2 de către caspase-3. OSGas2 de lungime completă cu un MW de 74 KDa este ilustrat ca o moleculă liniară cu un site de clivaj supus caspazei-3 DEYD 113, care este indicat de o săgeată. Digestia Caspase-3 a produs un fragment N-terminal cu un MW de 14 KDa (N) și un fragment C-terminal cu un MW de 60 KDa ( C ).
Imagine la dimensiune completă
Produsul de scindare a activității de tip caspază-3 amplificată de gaz2 în protoplastele de orez
Pentru a identifica funcția posibilă a produselor de scindare Gas2, fragmentele Gas2 N și C au fost exprimate în protoplastele mezofilelor de orez folosind un vector de expresie condiționată indusă de Dex, iar expresia fragmentului indusă în mod eficient de Dex (Fig. 6a). Comparativ cu expresia fragmentului N și controlul vectorului, expresia fragmentului C a dus la o creștere semnificativă a activității asemănătoare caspazei-3 după tratamentul termic (Fig. 6b). Interesant este că autofagozomii nu au fost detectați în protoplastele care exprimă cele două fragmente după tratamentul TDT (datele nu sunt prezentate).
( la ) Analiza RT-PCR a expresiilor fragmentului N-terminal (N) și fragmentului C-terminal (C) în protoplastele mezofile. ARN-ul total a fost preparat din protoplaste cu sau fără tratament Dex (control) timp de 18 ore. ARN 17S a fost utilizat ca control de încărcare. ( b ) Activitate asemănătoare caspazei-3 în protoplastele mezofile sub expresia fragmentului N-terminal (N) și a fragmentului C-terminal (C). Expresia N și C a fost indusă de Dex timp de 18 ore, iar apoi protoplastele au fost tratate la 48 ° C timp de 15 minute și lăsate să se recupereze la 28 ° C timp de 6 ore. Protoplastul cu vectorul de expresie condițional gol a fost folosit ca control. Un număr egal de fracții citosolice au fost incubate cu Ac-DEVD-AMC, iar fluorescența AMC a fost măsurată în 60 de minute de un microprocesor la 30 ° C. RFU/mg: unități relative de fluorescență per mg de proteină.
Imagine la dimensiune completă
Discuţie
⊥: calea de inhibare care a fost demonstrată în acest document; săgeată solidă: cale de activare, translocare sau degradare care a fost demonstrată în acest document; săgeată de bord: calea care nu a fost studiată în acest document; cerc circular: enzima putoasă de tip caspază-3. Vezi textul pentru detalii.
Imagine la dimensiune completă
Metode
Materiale vegetale și tratamente.
Oryza sativa L. cv. Răsadurile Nipponbare au fost cultivate în mediu MS lichid la 25 ° C folosind un ciclu de 16 ore de lumină/8 ore de întuneric. Pentru tratamentele de stres, răsadurile de 8 zile au fost incubate la 4 ° C în plăci sau în mediu lichid MS conținând 150 mM NaCI sau 40% PEG-6000 pentru diferite perioade de timp. Pentru stresul ER indus de DTT, protoplastele din 32 de suspensii de celule au fost incubate cu mediu MS lichid conținând DTT 6,4 mM timp de 18 ore la 26-28 ° C și apoi spălat cu mediu MS de două ori. Un mediu egal de apă a fost adăugat la mediu fără TDT ca un control negativ 41 .
Purificarea și identificarea proteinelor legate de activitatea de tip caspază-3
Pregătirea protoplastului
Celulele de suspensie a orezului de tip sălbatic RNAi și linii GAS2 au fost propagate în mod obișnuit și cultivate la 28 ° C. Protoplastele au fost izolate de la 3 la 4 celule în suspensie conform Maas și colab. 42. Pentru izolarea protoplastelor din țesutul verde, răsadurile de orez au fost cultivate în soluție nutritivă la 28 ° C timp de 7-10 zile. Răsaduri înalte de 10 cm au fost utilizate pentru izolarea protoplastelor conform Wang și colab. 43 .
Extracția ARN din răsaduri de orez
ARN-ul total a fost izolat din protoplastele de orez sau din rădăcinile răsadurilor folosind reactiv Trizol (Takara, Japonia). ARN total (5 μg) a fost utilizat pentru sinteza ADNc cu kitul de reactivi PrimeScript ™ RT cu gDNA Eraser (Takara, Japonia) conform instrucțiunilor producătorului.
Analiza cantitativă în timp real a reacției în lanț a polimerazei cu transcripție inversă
Reacția în lanț cantitativă în timp real a polimerazei a fost efectuată utilizând un aparat de PCR fluorescent cantitativ CFX 96 (Bio-Rad, Hercules, CA, SUA). Primeri specifici genei au fost folosiți pentru a detecta transcripțiile OsGAS2 și s-a utilizat ARNr 17S ca control intern. Fiecare probă a fost efectuată în trei experimente independente și secvențele de grund sunt detaliate mai jos.
OsGAS2 -F: TTGGTAAGGAGAAGGAGTTC; OsGAS2 -R: AGGCTGGTGGTACTATGT.
17sARN -F: ACACGGGGAAACTTACCAGGTC; 17sARN -R: CCAGAACATCTAAGGGCATCAC.
Construcția liniei celulare RNAi-OsGAS2.
Pentru a produce RNAi-OsGAS2, primerii Ri 1-F/Ri 1-R au fost proiectați pentru fragmentul 1 din OsGAS2 și primerii Ri 2-F/Ri 2-R pentru fragmentul 2 din OsGAS2 (site-urile Kpn I/Sac I și Mlu I/Site-urile BamH I sunt prezentate cu caractere cursive):
Ri 1-F: GG GGTACC GCTGAGCATGATATGCCAGAAC; Ri 1-R: C GAGCTC TCCTTCCGAACACGAGAAGC.
Ri 2-F: CG ACGCGT TCCTTCCGAACACGAGAAGC; Ri 1-R: CG GGATCC GCTGAGCATGATATGCCAGAAC.
$ config [ads_text16] nu a fost găsit
Fragmentele amplificate 1 și 2 au fost digerate de două ori cu Kpn I/Sac I și respectiv Mlu I/BamH I și apoi clonate în vectorul ARNi LH-FAD2-1390. Plasmidele recombinante au fost transformate în celule în suspensie de orez prin infecție cu Agrobacterium .
Localizarea subcelulară a proteinelor OsGAS2, OsGrp94 și HSP40 în protoplastele mezofilice din orez
Pentru studiul de localizare subcelulară, OsGAS2 (Os01g0276800), OSGrp94 (Os06g0716700) și ADNc putativ HSP40 (Os02g0100300) ADNc au fost amplificate folosind primeri specifici genei (site-ul BamH I și Kpn I sunt prezentate în italice):
OsGAS2: F-CG GGATCC ATGGGGCTCCACGCGATCC; R-GG GGTACC GCGAGTTCATCATGGTCACGCT.
OsGrp94: F-CG GGATCC ATGCGCAAGTGGGCGCTCTCC; R-GG GGTACC CTACAGCTCGTCCTTATCATA.
HSP40: F-CG GGATCC ATGGATGCTTCTCGCGTTGGC; R-GG GGTACC TTACTGGGACCCATTGAATTT.
Produsele PCR au fost confirmate prin secvențiere și apoi gel purificat cu trusa de extracție a gelului ADN AxyPrep (Oxigen, China). Produsele au fost apoi digerate cu BamH I și Kpn I și donate în vectorul de localizare subcelulară pXZP008 44. O genă reporter care codifică proteina fluorescentă verde (GFP) a fost fuzionată cu OsGAS2, OsGrp94 și OsHSP40, care este condusă de promotorul 35S al virusului mozaicului conopidei (35S: OsGAS2/OsGrp94/OsHSP40-GFP) și apoi transformată și exprimată tranzitoriu în mezofil orez. protoplaste. După incubare timp de 16 ore la 26 ° C în întuneric, protoplastele transformate au fost colorate cu ER-Tracker ™ Blue-White DPX 100 nM (E12353, Molecular Probes, SUA) timp de 30 de minute la 28 ° C în întuneric și spălate de două ori cu soluție W5. Fluorescența a fost vizualizată folosind un microscop confocal PerkinElmer UltraVIEW VoX. ER a fost identificat folosind E12353 ca control.
Exprimarea și purificarea recombinantelor tip A și D 110 A/D 113 A proteină OsGAS2 dublă mutantă.
Pentru a exprima OsGAS2 recombinant în Eschericia coli, ADNc OsGAS2 de lungime completă (Os01g0276800, WT) și mutantul D 110 A/D 113 A (Mu) au fost amplificate folosind primeri specifici genei (site-urile Nde I și EcoR I prezentate în italice):
WT: F-GGAATTC CATATG GCCTCCAGGCCGCCGCTCGA;
WT: RG GAATTC TTAGAGTTCAYCATGGTCACG;
D 113 A: F- ACGGGAGTGATGAGTATGCTAGCAATGTCACTTGCAAG
D 113 A: R- CTTGCAAGTGACATTGCTAGCATACTCATCACTCCCGT
D 110 A/D 113: F- TTGCTGCGACGGGAGTGCTGAGTATGCTAGCAATGTC
D 110/D 113 A: R- GACATTGCTAGCATACTCAGCACTCCCGTCGCAGCAA
Produsele PCR confirmate prin secvențiere au fost purificate pe gel și dublu digerate cu Nde I/EcoR I, donate în pET-28a marcate cu His și apoi transformate în E. coli DE3. Expresia a fost indusă folosind 0,3 mM izopropil-bD-1-tiogalactopiranozidă (IPTG) la 37 ° C timp de 4 ore. Celulele au fost recoltate și resuspendate în tampon de liză (NaH2P04 50 mM (pH 8,0), NaCl 300 mM). După întrerupere cu ultrasunete, amestecul a fost centrifugat la 10.000 × g timp de 1 oră la 4 ° C. Supernatantul rezultat a fost încărcat pe o coloană de rășină Ni-NTA (GenScript, China). După spălarea coloanei, OsGAS2 marcat cu His a fost eluat folosind tampon de eluție (50 mM NaH 2 PO 4 (pH 8,0), 300 mM NaCI și 250 mM imidazol).
Degradarea OsGAS2 prin activitate asemănătoare caspazei-3 in vitro
Proteina OsGAS2-His 6 purificată (100 μg) a fost incubată cu caspază-3 sau lizat de celule întregi din celule de suspensie de orez tratate termic timp de 5 ore la 37 ° C în tampon de testare (50 mM HEPES-KOH (pH 7,5), 10% glicerol, 50 mM KCl, 2,5 mM MgCl2 și 1 mM DTT). Produsele digerate au fost separate prin SDS-PAGE și detectate prin Western Blot folosind un anticorp monoclonal anti-poli histidină de șoarece (diluție 1: 1000, BOSTER, China) ca sondă.
Expresia condiționată a fragmentelor OsGAS2 în protoplastele mezofilelor de orez
Fragmente OsGAS2: Framentele N și C au fost amplificate folosind primeri specifici genei (siturile Xho I și Spe I sunt prezentate cu caractere italice):
Produsele au fost dublu digerate cu Xho I/Spe I și apoi clonate în mod direct în vectorul binar inductibil dexametazonă (Dex) pTA7002. Construcțiile rezultate și controlul vectorului (20-25 μg) au fost transformate în protoplaste de mezofilă din orez.
Analiza activității Caspase-3
Protoplastele transformate cu vectorul de control pTA7002 sau pTA7002-N/C au fost resuspendate în mediu W5 (suplimentat cu 10 mM Dex) și incubate într-o placă de cultură cu șase godeuri la 28 ° C în întuneric pentru perioade specifice de timp. După incubare, protoplastele au fost tratate la 48 ° C timp de 15 minute și lăsate să se recupereze la 28 ° C timp de 6 ore. Protoplastele au fost suspendate în tampon de liză (50 mM HEPES (pH 7,4), 100 mM NaCI, 250 mM zaharoză, 0,1% CHAPS, 1 mM DTT, 0,1 mM EDTA, 1 mg/mL pepstatinină, 8 mg/mL aprotinină, 10 mg/mL leupeptină). Suspensiile au fost omogenizate pe gheață și centrifugate la 12, 000 × g timp de 5 minute la 4 ° C, fracțiile citosolice solubile au fost colectate și incubate în tampon de testare (50 mM HEPES-KOH (pH 7,5), 10% glicerol, 50 mM KCl, 2,5 mM MgCl2 și 1 mM DTT) suplimentat cu 70 mM N-acetil-Asp-Glu-Val-Asp-7-amino-4-metilcumarină (Ac-DEVD-AMC, EnzoLife Sciences, SUA). Sistemul de reacție a fost incubat fără lumină la 30 ° C timp de 1 oră. Fluorescența a fost măsurată într-un cititor de microplăci (TECAN, SUA) la 380/460 nm. Diferența de fluorescență înainte și după incubare a fost normalizată față de concentrația de proteine corespunzătoare. Toate testele au fost efectuate folosind trei probe independente.
Microscop electronic
Protoplastele tratate cu TDT au fost fixate cu 2,5% (greutate/volum) glutaraldehidă în CPW-9M (pH 5,8) la 4 ° C peste noapte și post-fixate cu 1% (greutate/volum) tetroxid de osmiu timp de 3 ore la temperatura camerei. După colorare cu 1% (g/v) acetat de uranil la temperatura camerei timp de 2 ore, protoplastele au fost deshidratate folosind mai multe amestecuri diferite de etanol, apă și oxid de propilenă și apoi încorporate cu rășina Spurr. Secțiuni de măsurare
70 nm grosime au fost tăiate și colorate cu acetat de uranil și azotat de plumb. Probele de secțiune au fost observate cu un microscop electronic (H-7650, Hitachi).
Măsurarea conținutului de Ca 2+ citosolic
Vopseaua fluorescentă sensibilă la Ca2+, Fluo-3-AM a fost utilizată pentru a detecta modificarea relativă a fluorescenței dependente de Ca2+ în protoplaste. Protoplastele au fost incubate cu 5 μM Fluo-3-AM preîncălzit (Laboratoarele Dojindo, Japonia) timp de 30 de minute la 37 ° C, după cum se specifică în instrucțiunile producătorului. Apoi celulele au fost spălate de două ori și resuspendate în soluție de HBSS conținând 0,4 M manitol. Fluorescența Fluo-3 a fost măsurată cu un microscop confocal PerkinElmer UltraVIEW VoX utilizând lungimi de undă de excitație și emisie de 488 și respectiv 525 nm. Intensitatea fluorescenței protoplastelor a fost măsurată prin delimitarea protoplastului individual, iar fluorescența medie a protoplastelor a fost măsurată și analizată cu Image Pro Plus. 8-10 protoplaste au fost incluse pentru fiecare tratament.
Etichetarea LSD-urilor
Protoplastele tratați cu DTT și/sau 3-MA au fost colectate și incubate cu 50 nM LysoTracker Red DND-99 (Molecular Probes, SUA) timp de 20 de minute la 37 ° C, spălate cu tampon CPW-9M de trei ori și apoi examinate de un Microscop confocal PerkinElmer Ultra VIEW VoX. Lungimea de undă a excitației a fost de 561 nm și semnalele de emisie au fost măsurate la 590 nm.
Comentarii
Prin trimiterea unui comentariu, sunteți de acord să respectați Termenii și regulamentele comunității noastre. Dacă găsiți ceva abuziv sau nu respectă termenii sau liniile directoare, marcați-l ca inadecvat.
- Garzón anunță un nou sistem de etichetare pentru a promova o dietă sănătoasă - La Nueva España
- Lupta japoneză se pregătește pentru eventuala revenire la activitatea de Super-luptă
- Ceaiul negru, noul tău aliat de slăbire
- Compasiunea ca scop pentru noul an
- Acesta este noul motiv sănătos pentru a lua o cafea tare în fiecare dimineață