- Subiecte
- rezumat
- Introducere
- Rezultate
- Mer este exprimat aberant în LMA
- Mer activează supraviețuirea celulară și căile anti-apoptotice
- Inhibarea Mer cu eliminarea Mer shRNA
- Inhibarea Mer utilizând shRNA scade fosforilarea p38, ERK și CREB
- Inhibarea Merului induce apoptoza mieloblastelor in vitro
- Inhibarea Mer scade proliferarea mieloblastelor in vitro
- Reintroducerea Mer salvează capacitatea mieloblastelor de a se sustrage apoptozei și de a forma colonii
- Inhibarea Mer crește supraviețuirea fără leucemie in vivo
- Discuţie
- Informatie suplimentara
- Fișiere imagine
- Figura suplimentară S1
- Documente Word
- Tabel suplimentar S1
- Tabel suplimentar S2
- Tabel suplimentar S3
- Figuri și tabele suplimentare Legende
Subiecte
- AML
- Proteine oncogene
- Oncogeneza
- O remediere a erorilor la acest articol a fost publicată pe 5 septembrie 2016.
rezumat
Cercetări recente în AML au relevat doar câteva proteine kinaze exprimate aberant sau mutate care servesc drept potențiale ținte terapeutice. Raportul alelic ridicat al mutației interne de dublare a tandemului FLT-3 a fost asociat cu un prognostic slab și s-au dezvoltat inhibitori de molecule mici care vizează celulele care exprimă FLT-3. 6,7 Kit-ul AML pozitiv, găsit la un număr mare de pacienți recidivanti, este asociat cu un prognostic slab și a fost, de asemenea, vizat de inhibitori de molecule mici. 8,9 Sunt necesare opțiuni de terapie mai bine direcționate pentru a oferi un tratament mai eficient al LMA sau pentru a permite o scădere a chimioterapiei de intensitate mare.
În acest manuscris, raportăm că Mer este aberant supraexprimat în majoritatea eșantioanelor de la pacienții pediatrii și adulți cu LMA, comparativ cu progenitorii mieloizi normali. Mer este, de asemenea, exprimat în marea majoritate a liniilor de celule AML. Activarea Mer în liniile celulare AML a produs semnalizare de supraviețuire și proliferare, inclusiv fosforilarea ERK1/2 și AKT, precum și p38 MAPK (p38), MSK1, CREB, ATF1 și STAT6. În cele din urmă, arătăm că inhibarea Merului prin interferența ARN în liniile celulare AML umane duce la o creștere semnificativă a apoptozei, la scăderea potențialului de formare a coloniilor și la întârzierea dezvoltării leucemiei la șoarecii imunocompromiși. Direcționarea terapeutică a expresiei Mer aberante în LMA este atractivă, permițând potențial rezultate mai bune la pacienții cu risc crescut, terapie combinată de intensitate redusă la pacienții cu risc scăzut sau o opțiune terapeutică pentru cei care nu pot tolera chimioterapia cu risc ridicat.
Rezultate
Mer este exprimat aberant în LMA
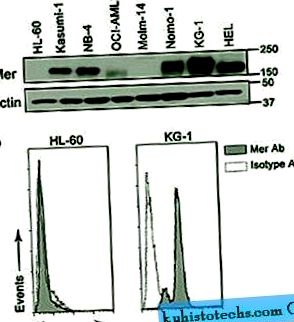
Pentru a evalua expresia Mer în LMA, am evaluat 14 linii celulare mieloide diferite. Mer a fost detectat prin imunoblotare în majoritatea liniilor celulare analizate ca o proteină de 150-180 kD (variația de mărime a fost atribuită glicozilării diferențiale 18). Analiza citometrică de flux a confirmat constatările; celulele care au fost pozitive pentru Mer au demonstrat o intensitate a fluorescenței mai mare comparativ cu celulele colorate cu controlul izotipului imunoglobulinei G1 de șoarece, în timp ce celulele negative nu (Figura 1 și Tabelul suplimentar S1). Analiza noastră a relevat un grad ridicat de corelație între rezultatele citometriei de imunoblot și flux și a indicat că există un anumit grad de expresie Mer în 86% (12 din 14) din liniile celulare AML. În această analiză a liniei celulare, expresia Mer nu a fost asociată cu nicio clasificare franco-american-britanică (FAB) sau a Organizației Mondiale a Sănătății (OMS), anomalie citogenetică, vârsta pacientului din care a fost derivată linia celulară și nici nu a fost corelată cu Alte caracteristici clinice cunoscute (tabelul suplimentar S1).
Mer este exprimat în linii celulare AML. ( la ) Lizatele celulare întregi derivate din liniile celulare AML au fost supuse analizei imunoblot cu un anticorp anti-Mer. Acest blot reprezentativ arată detectarea proteinei Mer (150-180 kD) în mai multe linii celulare AML. Actina a fost detectată ca un control de încărcare. ( b ) Expresia Mer pe suprafața celulei a fost determinată prin citometrie în flux după colorare cu un anticorp Mer primar anti-uman și un anticorp secundar conjugat PE (histogramă gri). Colorarea nespecifică a fost determinată folosind un anticorp primar de control al izotipului IgG1 și un anticorp secundar conjugat cu PE (histogramă albă). Sunt prezentate liniile celulare reprezentative Mer negative (HL-60) și Mer pozitive (KG-1).
Imagine la dimensiune completă
Mer este exprimat în majoritatea probelor de măduvă osoasă diagnosticate derivate de la pacienții cu LAM, dar nu și în măduva osoasă normală. Mieloblastele colectate în diagnosticul pacienților cu LMA au fost analizate prin citometrie în flux pentru exprimarea Mer. ( la ) Celulele care exprimă CD33 și CD45 uman au fost analizate după colorare cu un anticorp Mer anti-uman de șoarece și un anticorp secundar conjugat PE pentru expresia Mer (histogramă gri). Colorarea nespecifică a fost determinată folosind un anticorp martor de izotip IgG1 de șoarece și un anticorp secundar conjugat PE (histogramă albă). Profilurile reprezentative de citometrie în flux sunt prezentate pentru Mer-pozitive (> 20% celule pozitive), Mer-dim (10-20% celule pozitive) și Mer-negative (
Imagine la dimensiune completă
Inhibarea Mer cu eliminarea shRNA Mer
Pentru a studia rolul funcțional al Mer în AML, am introdus ARN scurt de ac de păr (shRNA) îndreptat împotriva Mer în cele două linii celulare utilizate mai sus. Nomo-1 și Kasumi-1 au fost transduse cu lentivirusuri care codifică una din cele două construcții diferite de shRNA (shMer1 și shMer4) pentru a scădea expresia Mer, sau s-a dezvoltat un shRNA non-silențios (shControl) și s-au dezvoltat clone stabile. S-a efectuat analiza imunoblotului de lizat celular întreg pentru a evalua eficacitatea inhibării Mer. Ambele clone de ștergere au redus în mod eficient expresia Mer, cu clona shMer4 din fiecare linie celulară având un clearance Mer ușor mai eficient decât clona shMer1 (Figura 4a). Aceste constatări au fost confirmate prin analiza citometrică de flux pentru expresia Mer de suprafață celulară, care a demonstrat clearance-ul eficient pentru ambele constructe, cu o inhibare ușor mai mare în celulele shMer4 (70-80% scădere) decât shMer1 (scădere 60%) comparativ cu shControl (Figura 4b)
Expresia proteinei Mer este redusă prin expresia shRNA în liniile celulare AML. Celulele Kasumi-1 și Nomo-1 au fost infectate cu particule lentivirale care conțin construcții de ARN de ac de păr (shRNA) care vizează Mer (shMer1, shMer4) sau GFP ca un control fără silențiere (shControl). Eliminarea lui Mer a fost confirmată de ( la ) analiza imunoblot a lizatelor celulare întregi și ( b ) citometrie în flux folosind anticorp anti-Mer. Valorile reprezintă mijloace și sunt derivate din trei experimente independente. ( c ) Celulele Kasumi-1 și Nomo-1 parentale și conținând shRNA au fost incubate în mediu fără ser timp de 2-3 ore urmate de un tratament de 10 minute cu 200 nM rhGas6 ((+) Gas6) sau tampon (foamea de ser mort) . Lizatele de celule întregi au fost supuse analizei imunoblotului cu anticorpi specifici pentru proteinele fosforilate și totale analizate în Figura 3e. Dintre acestea, p38, ERK1/2 și CREB au demonstrat în mod constant o scădere a fosforilării corespunzătoare nivelului de Mer, atunci când sunt stimulate cu Gas6.
Imagine la dimensiune completă
Inhibarea Mer utilizând shRNA scade fosforilarea p38, ERK și CREB
Pentru a evalua care căi ulterioare au fost cele mai afectate de inhibarea Mer folosind shRNA, am analizat în continuare proteinele care au demonstrat o fosforilare crescută după stimularea Gas6 (de exemplu, MSK1, p38, ERK, AKT, CREB, ATF1 și STAT6) folosind Merckdown Nomo-1 și Kasumi -1 linii celulare. Când celulele înfometate cu ser au fost stimulate cu Gas6, liniile celulare de demolare au demonstrat în mod constant o scădere concomitentă a fosforilării p38, ERK și CREB, comparativ cu cele tratate cu tampon singur (Figura 4c).
Inhibarea Mer induce apoptoza mieloblastelor in vitro
Efectele fenotipice ale inhibiției Mer asupra LMA au fost evaluate in vitro. Celulele Nomo-1 și Kasumi-1 cu sau fără constructele shRNA au fost colorate cu iodură Yo-Pro-1 și iodură de propidiu după 18 ore de înfometare în ser și supuse analizei citometrice în flux. Celulele care au luat doar iodură Yo-Pro-1 (apoptoză timpurie) și cele care au luat iodură Yo-Pro-1 și iodură de propidiu (apoptoză tardivă și necroză) au fost incluse în analiză; Celulele care iau doar iodură de propidiu (celule moarte) au fost excluse pentru a elimina posibilitatea analizei celulelor care au murit înainte de analiză. Liniile celulare cu niveluri reduse de Mer au demonstrat un grad mai mare de apoptoză; ∼ 35% (shMer1) și 55% (shMer4) din celule au fost considerate apoptotice ca răspuns la foamea serică. Aceasta a fost semnificativ mai mare decât apoptoza de 15-20% observată în liniile celulare martor (P
Merckdown conferă susceptibilitate la apoptoză. ( la ) Celule shRNA (shControl) și Merckdown (shMer1, shMer4) de control parental, fără silențiere, celulele Kasumi-1 și Nomo-1 au fost înfometate sau cultivate în mediu complet timp de 18 ore înainte de iodura de propidiu și iodura I-Pro-1. Celulele apoptotice au fost identificate prin citometrie în flux. Sunt prezentate profiluri reprezentative de citometrie în flux. Sunt prezentate procentele de celule apoptotice timpurii (cadranul inferior drept; Yo-Pro +/PI−) și apoptoza tardivă/necroză (cadranul drept superior; Yo-Pro +/PI +). ( b ) Datele cumulative demonstrează o acumulare semnificativă de celule apoptotice în celulele Kasumi-1 și Nomo-1 atunci când Mer este inhibat de shRNA (* P
Îndepărtarea Mer scade potențialul de formare a coloniilor AML. Celulele shARN controlate parental, nesilențiate (shControl) și Merckdown (shMer1, shMer4) celulele Nomo-1 și Kasumi-1 au fost cultivate în metilceluloză timp de 13 zile. ( la ) Sunt prezentate imagini reprezentative ale plăcii liniei celulare Nomo-1. ( byd ) Numărul total de colonii a fost determinat prin demonstrarea unei scăderi semnificative statistic a formării coloniilor atunci când Mer (* * P
Inhibarea expresiei Mer prelungește supraviețuirea într-un model murin de LMA. Șoarecii NOD-SCID-gamma au fost iradiați cu 200 cGy și transplantați cu cinci milioane de ARN-1 parental (Parental, n = 8), shRNA nedirecționat (shControl, n = 8) sau Merckdown (shMer1 n = 16, shMer4 n = 14 ) celule prin injectare intravenoasă. Analiza Kaplan-Meier care compară supraviețuirea se dovedește a demonstra o prelungire semnificativă statistic (P 20
Mecanismul supraexpresiei Mer în LMA nu este clar; Mecanismele posibile includ adaptări la nivel transcripțional sau translațional, cum ar fi metilarea promotorului modificat sau reglarea microARN. Expresia crescută a lui Axl, un alt membru al familiei tirozin kinazei Tyro-3/Axl/Mer, în leucemia mieloidă după tratamentul chimioterapic, a coincis cu metilarea crescută a promotorului Axl. 21 În cancerul de sân, reducerea la tăcere a microARN-ului supresor al Mer a fost asociată cu o metastază crescută. 22 Expresia anormală a Mer în leucemie nu a fost încă asociată cu modificări epigenetice specifice și este necesară o evaluare suplimentară a mecanismului supraexprimării Mer în LMA.
Aceste rezultate sugerează, de asemenea, că liniile celulare AML se bazează pe semnalizarea Mer pentru a susține viabilitatea sub stres și in vivo. În plus, aceste date demonstrează o rațiune pentru terapia țintită anti-Mer atât pentru LMA pentru adulți, cât și pentru copii. Potențial, inhibarea Mer poate avea un efect semnificativ clinic la pacienții de la ambele capete ale spectrului de vârstă al LMA, fie ca monoterapie, fie în combinație cu terapiile actuale pentru LMA.
În prezent, există câțiva agenți de translație care vizează Mer în dezvoltarea preclinică. Unul dintre aceștia este un anticorp monoclonal Mer descris recent, care a arătat migrația tumorală scăzută și supraviețuirea în liniile celulare glioblastom multiforme. 32 Există, de asemenea, inhibitori selectivi ai tirozin kinazei cu molecule mici Mer care scad în mod eficient fosforilarea Mer in vitro și in vivo. 33
Datele noastre oferă dovada conceptului că Mer este o țintă terapeutică în LMA și va duce probabil la dezvoltarea în continuare a agenților vizați Mer, inclusiv anticorpi suplimentari și/sau inhibitori specifici de molecule mici. Aceste noi terapii au potențialul de a afecta pacienții cu LMA, precum și pacienții cu alte afecțiuni maligne caracterizate prin dependență de Mer și pot oferi un mijloc de îmbunătățire a supraviețuirii cu o toxicitate scăzută în raport cu schemele chimioterapeutice standard actuale.
- Motivul pentru care avocado contribuie la pierderea în greutate
- Motivul pentru care avocado contribuie la pierderea în greutate Salud La Revista El Universo
- Auto-monitorizarea ajută la menținerea greutății
- Inhibitori DPP-4 împotriva unui; Logo-urile receptorului GLP-1 după eșecul monoterapiei
- Lipsa somnului schimbă metabolismul și contribuie la creșterea în greutate El Diario Vasco