Fabiola Hernández-Rosas 1, Juan Santiago-García 2 *
1 doctorand, Institutul de Cercetări Biologice, Universitatea Veracruzana în Științe Biomedice, Institutul de Cercetări Biologice.
2 Cercetător principal cu normă întreagă de cercetări biologice, Institutul de cercetări biologice, Universitatea Veracruzana.
* Corespondență: Juan Santiago-García
Institutul de Cercetări Biologice, Universidad Veracruzana
E-mail: [e-mail protejat]
Abstract
Ritmurile circadiene sunt ritmuri biologice cu o durată apropiată de 24 de ore, ele ne reglează activitatea metabolică, hormonală și comportamentală zilnică. Acestea sunt stabilite prin activitatea transcripțională intrinsecă a unui grup de gene, numite gene de ceas, care sunt exprimate ritmic în creier și în țesuturile periferice. Studii epidemiologice recente sugerează că tulburările de ritm circadian reprezintă un factor de risc pentru dezvoltarea cancerului la om. Interesant este că s-a descoperit că șoarecii mutanți ai genei ceasului Per2 dezvoltă tumori. Cu aceste dovezi, au fost analizate biopsiile diferitelor tipuri de cancer la om, arătând că expresia genelor Per1, Per2 sau Per3 este considerabil redusă, comparativ cu țesutul normal. În acest articol vom analiza dovezile care sugerează o relație între modificările ritmurilor circadiene și expresia genelor ceasului, cu dezvoltarea cancerului.
Introducere
Viața este un fenomen ritmic. Activitatea și funcțiile ființelor vii se manifestă ca variații periodice sau ritmice și nu ca un proces continuu. Aceste variații sunt cunoscute sub numele de ritmuri biologice. În natură, se observă diverse ritmuri biologice; cei cu o periodicitate mai mică de 24 de ore sunt numiți ultradieni, precum: consumul de alimente, ritmul cardiac, odihnă și activitate etc. La rândul lor, ritmurile biologice cu o periodicitate apropiată de 24 de ore sunt cunoscute sub numele de circadian, precum: ciclul somnului și trezirii, eliberarea anumitor hormoni etc. În timp ce ritmurile biologice cu o periodicitate mai mare de o zi sunt denumite infradian, cum este cazul ciclului menstrual, al ciclului estru, al hibernării, printre altele.
La mamifere, ritmurile circadiene sunt generate de un ceas biologic central sau „stăpân”, situat în structuri hipotalamice numite nuclei suprachiasmatici (NSQ) din sistemul nervos central și de ceasuri situate în celule din diferite țesuturi, cunoscute sub numele de oscilatoare., 2]. Împreună, aceste ceasuri sunt sisteme capabile să genereze o ordine temporală în activitățile organismului, ele oscilează cu o perioadă regulată și folosesc aceste oscilații ca o referință temporală internă pentru a regla ritmul biologic al multor funcții corporale, cum ar fi: somnul și trezirea, odihna și activitatea, temperatura corpului, tensiunea arterială, debitul cardiac, consumul de oxigen, echilibrul fluidelor și secreția glandei endocrine [1,3]
Genele ceasului și mecanismul molecular al ceasului circadian
Studiile de mutageneză efectuate la musca fructului (Drosophila melanogaster) au făcut posibilă identificarea muștelor mutante cu modificări ale ritmului circadian. Caracterizarea și analiza acestor mutanți au permis descoperirea unui număr mic de gene implicate în generarea și menținerea ritmului circadian la aceste insecte. Acest grup de gene a fost numit gene de ceas sau „gene de ceas”. Ulterior, genele omoloage au fost clonate la mamifere și au fost identificate noi gene de ceas de la hamsteri sau șoareci mutanți. La mamifere, au fost descrise cel puțin nouă gene de ceas: Per1, Per2, Per3, Cry1, Cry2, Clock, Bmal1, Casein kinase Ie (CkIe) și Rev-Erb_ [1].
Mecanismul molecular al ceasului circadian central și al oscilatorilor circadieni periferici implică interacțiunea semnalelor pozitive și negative care reglează transcrierea ritmică a genelor ceasului. Acest grup de gene este responsabil pentru controlul activității circadiene la toate ființele vii [1,4]. Exprimarea acestor gene este reglată prin intermediul a două bucle de activare/reprimare transcripțională. Bucla semnalului pozitiv este controlată de genele Clock și Bmal1, în timp ce bucla negativă de genele Per și Cry [1,5].
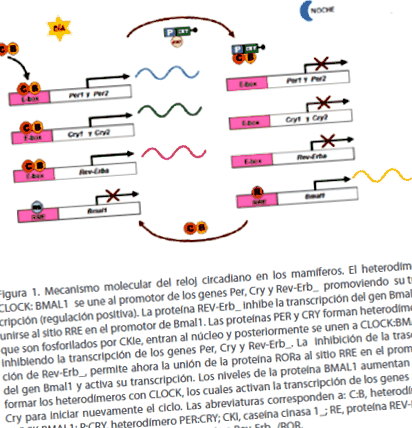
Cel mai acceptat model pentru a explica mecanismul molecular al ceasului circadian la mamifere este șoarecele. Dacă așezăm funcționarea mașinii ceasului circadian central (NSQ) al mouse-ului în contextul unei zile circadiene de 24 de ore, se întâmplă următoarele: la începutul zilei circadiene (dimineața devreme), transcrierea Per gene și Cry este activat de heterodimerii care formează proteinele CLOCK: BMAL1, care se leagă de secvențele reglatoare cunoscute sub numele de cutii E, situate în promotorii genelor Pery Cry pentru a activa transcrierea lor. Mesagerii acestor gene sunt traduse în proteinele lor corespunzătoare (PER și CRY) în citosol. Spre mijlocul zilei circadiene (începutul nopții), proteinele PER și CRY se asociază și formează heterodimeri (PER: CRY), care sunt fosforilați de enzima CKI și apoi sunt translocați în nucleu, unde se acumulează. PER: heterodimeri CRY sechestrează Ceas: heterodimeri BMAL1, interferând cu legarea lor de site-ul promotor al genelor Per și Cry, inhibând transcrierea lor. Prin urmare, proteinele PER și CRY acționează ca regulatori negativi [1,5].
Ceasul: heterodimerii BMAL1 activează, de asemenea, transcrierea genei care codifică un receptor orfan nuclear cunoscut sub numele de Rev-Erb_. Odată ajuns în nucleu, proteina REV-ERB_ se leagă de promotorul genei Bmal1 și își reprimă transcrierea, provocând scăderea nivelului de ARNm Bmal1. Pe de altă parte, când dimerii proteinelor PER: CRY intră în nucleu și inhibă transcrierea lui Per și Cry, inhibă și transcrierea Rev-Erb_ și stimulează indirect transcrierea genei Bmal1. În absența REV-ERB_, proteina RORa (receptorul orfan legat de RAR) se leagă de promotorul genei Bmal1 și activează transcrierea acesteia. În consecință, nivelurile proteinei BMAL1 cresc la sfârșitul nopții, favorizând formarea heterodimerilor CLOCK: BMAL1, care activează transcrierea genelor Per și Cry pentru a relua din nou ciclul (figura 1) [1.5].
figura 1. Mecanismul molecular al ceasului circadian la mamifere. Ceasul: heterodimerul BMAL1 se leagă de promotorul genelor Per, Cry și Rev-Erb_ promovând transcrierea lor (reglare pozitivă). Proteina REV-Erb_ inhibă transcrierea genei Bmal1 prin legarea la site-ul RRE de pe promotorul Bmal1. Proteinele PER și CRY formează heterodimeri care sunt fosforilați de CKIe, intră în nucleu și se leagă ulterior de CLOCK: BMAL1, inhibând transcrierea genelor Per, Cry și Rev-Erb_. Inhibarea transcripției Rev-Erb_ permite acum legarea proteinei RORa de situsul RRE în promotorul genei Bmal1 și activează transcrierea acesteia. Nivelurile proteinei BMAL1 cresc pentru a forma heterodimerii cu CLOCK, care activează transcrierea genelor Per și Cry pentru a începe din nou ciclul. Abrevierile corespund: C: B, CLOCK: BMAL1 heterodimer; P: CRY, heterodimer PER: CRY; CKI, cazeină kinază 1_; RE, proteina REV-ERB_; R, proteină RORa; RRE, element de răspuns la Rev-Erb_/ROR.
Efectele opuse ale dimerilor CLOCK: BMAL1 și PER: CRY din transcripție asigură faptul că mesagerii Per și Cry oscilează în antifază cu mesagerul Bmal1. Nivelurile maxime și minime în exprimarea acestor gene apar cu o periodicitate apropiată de 24 de ore, în acest fel stabilesc ritmul circadian în organisme. De exemplu, în NSQ, vârful maxim al expresiei Bmal1 apare la mijlocul nopții, în timp ce vârful maxim al mesagerilor Per și Cry are loc la prânz [1].
Ceasuri circadiene în țesuturile periferice
Ceasurile sau oscilatoarele circadiene există într-o mare varietate de țesuturi periferice, similare cu cele care funcționează în neuroni NSQ [14,15,16]. Atât neuronii NSQ, celulele țesutului periferic, cât și fibroblastele cultivate prezintă modele temporale de exprimare a genei ceasului. O serie de studii recente au arătat că genele Per, Cry și Bmal1 prezintă expresie ritmică în diferite țesuturi, cum ar fi: ficat, inimă, plămâni, rinichi, fibroblaste cultivate și altele [1,2,15,16]. Cu toate acestea, spre deosebire de NSQ, oscilațiile circadiene în expresia genelor de ceas din țesuturile periferice ale mamiferelor scad rapid atunci când sunt menținute ca explante în cultură. În țesuturile periferice de șobolan, expresia circadiană a genelor de ceas se pierde în 2 până la 7 zile, în timp ce la fibroblastele cultivate după 3 până la 4 cicluri [15,17]. În contrast, expresia circadiană a genelor ceasului în NSQ cultivat este menținută mai mult de o lună [17,18]. Acest lucru a condus la postularea că NSQ este stăpânul sau ceasul central cu un ritm circadian intrinsec care sincronizează, prin diferite semnale neuronale și umorale, activitatea oscilatoarelor circadiene situate în țesuturile periferice și alte regiuni ale creierului.
Pe de altă parte, s-a demonstrat că diferite semnale, cum ar fi administrarea analogilor glucocorticoizi și modificarea programului de hrănire, modifică tiparele circadiene de expresie ale genelor ceasului în ficat și alte țesuturi periferice, dar nu afectează expresia în NSQ [15-17, 19, 20]. Acest lucru sugerează că, în anumite condiții metabolice sau fiziologice, controlul local al ritmului oscilatoarelor periferice poate fi decuplat de controlul NSQ, pentru a se adapta la condiții particulare fără a afecta ceasul central. La rândul său, acest lucru ar permite optimizarea fiziologiei celulare, în așa fel încât expresia anumitor gene este restricționată atunci când sunt necesare produsele lor. Când aceste condiții particulare dispar, NSQ poate sincroniza oscilatoarele periferice înapoi la ritmul lor normal [2,16,17,19].
Gene de ceas și cancer
Pentru a înțelege funcția fiecărei gene de ceas în mecanismul molecular responsabil pentru generarea ritmurilor circadiene, au fost dezvoltate o serie de șoareci mutanți sau knock-out, în care funcția acestor gene. Acești șoareci mutanți prezintă pierderea ritmului circadian al activității locomotorii și a ingestiei de apă. O descoperire surprinzătoare a apărut la dezvoltarea șoarecilor mutanți ai genei ceasului Per2, care, pe lângă pierderea ritmului circadian, a dezvoltat hiperplazii ale glandei salivare, limfoame și teratoame cutanate [13]. Prin tratarea șoarecilor Per2 mutanți cu radiații gamma, un agent care dăunează ADN-ului, dezvoltarea tumorii a fost accelerată, inducând moartea prematură la aceste rozătoare. În schimb, acest fenotip nu a fost observat la șoarecii martor (nemutanți) supuși aceluiași tratament [13].
Pe baza acestor observații, diferitelor grupuri de cercetare din întreaga lume li s-a atribuit sarcina de a caracteriza expresia genelor ceasului în biopsiile diferitelor tipuri de cancer la om. În aceste studii, s-a constatat o scădere a expresiei genelor de ceas, în special a genelor Per1 și Per2, în cancerul de sân [21,22], cancerul pulmonar [24], cancerul endometrial [25], cancerul de prostată [ 26], cancer pancreatic [27], printre altele (tabelul 1).
tabelul 1. Exprimarea genelor Per în diferite tipuri de cancer
Pentru a încerca să explice scăderea expresiei genelor Per în biopsiile de cancer, au fost analizate tiparele de metilare ale acestor gene, deoarece se știe că metilarea promotorilor, în secvențe CpG, constituie un mecanism epigenetic care reglează expresia genelor. În acest sens, s-a constatat că situsurile CpG din promotorul genei hPer1 sunt metilate în mai mult de 50% din cazurile de cancer mamar, ceea ce explică scăderea nivelului de expresie al acestora [22]. Un studiu similar, la pacienții cu leucemie mieloidă cronică, a relevat că metilarea site-ului promotor al genelor hPer1, hPer2 și hPer3 se corelează direct cu scăderea expresiei acestor gene [23,28]. Aceste dovezi sugerează că expresia genelor Per este controlată parțial de mecanisme epigenetice.
Genele Per1 și Per2 sunt, de asemenea, supresoare tumorale
Proliferarea celulelor este un proces esențial pentru formarea, repararea și întreținerea bunei funcționări a tuturor țesuturilor și organelor din corp. Genele cunoscute sub numele de supresoare tumorale sunt responsabile pentru orchestrarea proceselor implicate în controlul proliferării celulare și al morții într-un organism. Aceste gene acționează ca regulatori negativi ai proliferării celulare, atunci când nu sunt prezente sau sunt inactive din cauza mutațiilor, ele împiedică proliferarea normală a celulei, dobândind proprietăți proliferative caracteristice celulelor tumorale.
masa 2. Efectul modificărilor în expresia genelor Per1 și Per2 în liniile celulare canceroase
Figura 2. Genele Per1 și Per2 participă la puncte de control care opresc proliferarea celulelor. Schema arată diferite puncte pentru care s-au acumulat dovezi experimentale cu privire la posibila participare a genelor Per la controlul ciclului celular. Abrevierile corespund: Cdk, kinază dependentă de ciclină; ATM, Ataxia mutată Telangiectasia kinază; ATR, kinaza legată de proteina ATR; Chk1, Checkpoint kinaza 1; Chk2, Checkpoint kinaza 2; Gadd45a proteină 45 alfa pentru inducerea creșterii, detectarea și deteriorarea ADN-ului; Cdc25, ciclul de diviziune celulară fosfatază 25.
Alte date recente obținute de Gery și colab (2006) au arătat că Per1 interacționează cu ATM și Chk2 kinaze, care sunt implicate în mecanismele de răspuns la deteriorarea ADN-ului [24]. Aceste kinaze au un impact major asupra mai multor puncte de control ale ciclului celular și asupra răspunsului împotriva agenților care dăunează ADN-ului. Când ATM kinaza detectează deteriorarea ADN-ului, aceasta răspunde prin creșterea activității sale biochimice, care modifică alte proteine, fiecare fiind responsabilă de un anumit răspuns în repararea deteriorării ADN-ului, blocarea ciclului celular și inducerea apoptozei.
Patologii asociate cu tulburări de ritm circadian Ființa umană prezintă o serie de modificări fiziologice în cursul zilei circadiene (24 h). De exemplu, modificările hormonale care apar la începutul zilei, în principal la nivelul axei glandei hipotalamo-hipofizo-suprarenale, duc la eliberarea catecolaminelor în fluxul sanguin cu efectul lor activ activ corespunzător asupra funcțiilor organice. Acest lucru face posibil ca organismul să rămână treaz și activ datorită creșterii tonusului muscular și a activității nervoase. Eliberarea de catecolamine scade în timpul nopții, ceea ce scade și efectul său activator și apare somnul, perioadă în care funcțiile intelectuale conștiente sunt anulate pentru a da loc celor inconștiente. Prin urmare, integritatea structurii biologice circadiene este esențială pentru o funcționare eficientă biologică și cognitivă.
Perspective asupra cronobiologiei și cronoterapiei cancerului
Concluzii
Modificările ritmului circadian s-au dovedit a fi un factor de risc pentru dezvoltarea diferitelor patologii, inclusiv a cancerului, ceea ce sugerează că integritatea ritmului circadian este un aspect important pentru sănătate. De asemenea, s-a stabilit că defectele în exprimarea anumitor gene de ceas, cum ar fi genele Per, duc la deficiențe în controlul ciclului celular și la răspunsul la deteriorarea ADN-ului, precum și la dezvoltarea tumorilor la rozătoare. . Cu alte cuvinte, ceasul circadian nu numai că organizează diverse procese biologice și comportamentale, ci joacă și un rol fundamental în fiziologia celulară. Cu toate acestea, sunt necesare mai multe studii pentru a clarifica rolul ceasului circadian în proliferarea celulelor, apoptoza și mecanismele de transformare malignă. Aceste investigații vor avea o mare importanță, deoarece vor permite generarea de cunoștințe valoroase pentru dezvoltarea de noi opțiuni terapeutice împotriva cancerului.
Mulțumiri
Consiliului Național de Știință și Tehnologie (CONACYT), pentru bursa acordată Fabiola Hernández-Rosas (colegul nr: 223273) și PROMEPSEP pentru finanțarea acordată lui Juan Santiago-García (PTC-270).
- Valley Medical Slabire rapidă; Programe medicale accesibile de slăbire
- T; nodul sentinel cinic în chirurgie; a de c; alăptarea într-un spital fără
- Ceas Rond Touch cu activitate din oțel
- Ce tip de corp aveți? Măr, pere sau clepsidră? Jurnal nou
- Swimmo - monitor de ritm cardiac și ceas de înot, contor de lungime, ceas de piscină • Swimmo