Consultați articolele și conținutul publicat în acest mediu, precum și rezumatele electronice ale revistelor științifice la momentul publicării
Fiți informat în permanență datorită alertelor și știrilor
Accesați promoții exclusive la abonamente, lansări și cursuri acreditate
Jurnalul de Medicină și Cercetare este o publicație științifică a Universității Autonome din statul Mexic. La fiecare șase luni, acceptă articole în spaniolă și engleză și ia în considerare pentru publicare acele lucrări legate de cercetarea medicală în toate aspectele sale. Articolele originale, articolele de recenzie, scrisorile științifice, liniile directoare clinice, consensul, comentariile editoriale, scrisorile către redactori, articolele despre istoria și arta medicinei, cu caracter academic care includ rezultate ale cercetărilor cu conținut din domenii, sunt acceptate pentru publicare. cardiologie, pneumologie, nefrologie, gastroenterologie, reumatologie, ginecologie, genetică, farmacologie, imunologie, biologie moleculară, medicină internă, sănătate publică, medicină generală, printre altele.
Jurnalul de Medicină și Cercetare este un jurnal științific al Universidad Autónoma del Estado de México. Publică, de două ori pe an, articole în spaniolă și în engleză și va lua în considerare pentru publicare acele lucrări legate de investigații medicale sub toate aspectele sale. Revista acceptă pentru publicare articole originale, articole de revizuire, scrisori științifice, ghiduri clinice, consens, comentarii editoriale, scrisori către redactori, articole și istoria artei medicinei, inclusiv cu rezultate ale cercetărilor academice cu conținut din domeniul cardiologiei, nefrologie, gastroenterologie, reumatologie, ginecologie, genetică, farmacologie, imunologie, biologie moleculară, medicină internă, sănătate publică, medicină generală, printre altele.
Urmareste-ne pe:
- Introducere
- Fiziopatologie
- Manifestari clinice
- Diagnosticul și tratamentul
- Finanțare
- Introducere
- Identificarea conceptuală a sindromului Leigh
- Bazele biochimice ale sindromului Leigh
- Fiziopatologie
- Manifestari clinice
- Moștenirea sindromului Leigh
- Diagnosticul și tratamentul
- Finanțare
- Conflict de interese
- Mulțumiri
- Bibliografie
Studiul structurii, fiziologiei și tulburărilor legate de mitocondrii au fost subiecte de cercetare pentru mulți oameni de știință de-a lungul istoriei, ne putem referi la anul 1951 în care Denis Leigh descrie cazul unui copil cu propriile sale manifestări clinice ale sindromului care astăzi poartă numele său, despre care se știe din ce în ce mai mult, dar s-au făcut puține progrese în stabilirea unui tratament care reușește să crească speranța de viață a celor care suferă de el.
Corpul uman ca o mașină perfectă necesită aportul de combustibili biologici (carbohidrați, lipide și proteine) necesare pentru a obține energia chimică necesară diferitelor procese biologice și astfel menține homeostazia. Metabolizarea acestor combustibili în organism se realizează prin utilizarea diferitelor căi catabolice și anabolice, care necesită funcționarea coordonată a elementelor celulare, adică o bună comunicare între organele oricărei celule din corp.
După metabolismul corect al biocombustibililor din celule, obținem în cele din urmă molecule de energie chimică sub formă de ATP care sunt necesare pentru a efectua procese precum; trecerea moleculelor prin membrana celulară, mișcarea flagelilor, contracția musculară, printre multe alte funcții vitale. Cea mai mare parte a acestei energii chimice este obținută datorită participării mitocondriilor, în structura căreia se află importantul lanț respirator pentru a efectua fosforilarea oxidativă și în final obținerea ATP.
Identificarea conceptuală a sindromului Leigh
Tulburare neurodegenerativă secundară absenței congenitale a: complexului piruvat dehidrogenază, complexului I, IV sau V al lanțului respirator 1 .
Bazele biochimice ale sindromului Leigh
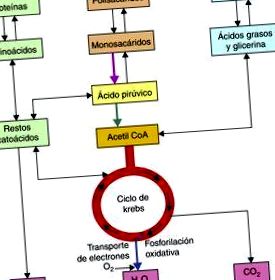
Căile metabolice utilizate atât în catabolismul glucidelor, lipidelor, cât și proteinelor converg în mitocondrii după formarea finală a moleculelor de acetil CoA 2, care vor fi ulterior metabolizate de ciclul acidului tricarboxilic pentru a obține cofactori reduși, NADH + H și FADH2., care va fi apoi oxidat în lanțul respirator pentru a obține molecule de ATP (fig. 1).
Obținerea acetil CoA.
În cazul glucidelor, atât glicoliza aerobă, cât și cea anaerobă sunt căi importante pentru utilizarea acestor molecule, după seria reacțiilor pe care glicoliza anaerobă le implică în citosolul celular, ajungem la obținerea piruvatului, care va fi un substrat pentru piruvatul dehidrogenază. complex care va oxida molecula piruvatului la Acetil CoA în mitocondrii.
Molecula de Acetil CoA este formată din Coenzima A, a cărei moleculă conține adenină, riboză, acid pantotenic și o grupare tiol, acesta din urmă reacționează cu grupările carboxil, astfel încât molecula de Acetil CoA să fie obținută în final, este un compus cu energie ridicată, astfel încât să vă poate dona grupul acetil în ciclul acidului tricarboxilic.
În ciclul acidului tricarboxilic, molecula de acetil CoA va fi metabolizată la CO 2 și H 2 O, la fel în seria de reacții care fac parte din acest ciclu; 3 NADH + H, 1 FADH 2 și o moleculă GTP. Cofactorii reduși (NADH + H și FADH2) care sunt produși în acest ciclu sunt importanți deoarece acționează ca transportori ai electronilor obținuți după catabolismul biocombustibililor, prin urmare, acești cofactori rezultați din ciclul Krebs sau din acizii tricarboxilici, vor donați ulterior acești electroni primului complex al lanțului respirator în cazul cofactorului NADH + H sau Complexului II în cazul cofactorului FADH2, după o serie de reacții în care acești cofactori sunt oxidați și complexele sunt reduse ( fig. 2).
Cofactorii reduși obținuți în glicoliza anaerobă a citosolului celular nu pot traversa membrana mitocondrială, prin urmare, pentru a intra utilizează navetele glicerol - 3 - fosfat (în principal în celulele creierului și muscular) și malatul - aspartat (în principal în ficat și inimă), care introduc electronii cofactorilor reduși din citoplasmă în mitocondrii.
Trecerea electronilor prin lanțul respirator începe în complexul I sau II, ulterior trec la ubiquinonă (Q), apoi la complexul III, aceasta se reduce la citocrom și în cele din urmă citocrom se reduce la complexul IV, care va dona 2 electroni oxigenului pentru formarea unei molecule de apă, trebuie remarcat faptul că trecerea electronilor prin complexele enzimatice ale lanțului respirator se efectuează de la complexul care are un potențial de reducere standard mai mic la complexul care are un potențial de reducere standard mai mare, adică de la complexul cu o afinitate mai mică pentru electroni la complexul care are o afinitate mai mare pentru ei.
Trecerea electronilor prin complexele lanțului respirator este cuplată cu pomparea protonilor de către complexele I, III și IV în spațiul intermembranar, creând astfel un gradient electrochimic în acel spațiu, tendința protonilor. Pentru a reveni la matrice și stabilizați gradientul de pe ambele părți ale membranei mitocondriale interioare, le va permite să treacă prin complexul ATPază, a cărui structură se bazează pe o subunitate F 1 și F 0. Subunitatea F 0 formează canalul prin care trec protonii, în timp ce subunitatea F 1 este locul în care, de la ADP și Pi, are loc formarea moleculei ATP, prin urmare este important să rețineți că energia generată după protonii trec prin acest canal permit eliberarea moleculei de ATP care a fost formată de substraturi (ADP și Pi), nu trebuie crezut că energia obținută prin trecerea protonilor este în mod corespunzător energia conținută în ATP.
După obținerea moleculelor de ATP, acestea pot fi utilizate în gama largă de procese fiziologice care necesită o bună funcționare și menținerea unui echilibru vital pentru ființa umană.
În organism există țesuturi care se remarcă prin necesitatea unui metabolism oxidativ intact care să asigure obținerea energiei necesare pentru a-și îndeplini funcția în mod eficient, în cadrul acestor țesuturi predomină sistemul nervos central, în cadrul căruia se remarcă ganglionii bazali. pentru prezența unei activități metabolice ridicate, situație care îi face vulnerabili la deteriorarea celulelor, astfel încât eșecurile în metabolismul celular al acestor structuri se vor reflecta semnificativ în funcțiile de control pe care le desfășoară în organism.
Ganglionii bazali (globus pallidus, putamen, nucleu caudat, nucleu subtalamic și substantia nigra) sunt acumulări de corpuri neuronale a căror funcție principală este de a controla debutul, amplitudinea și viteza mișcărilor 4, la un copil cu sindrom Leigh eșecul metabolismului oxidativ și necroza acestor structuri se traduce prin defecte de mișcare, prin urmare ele se caracterizează prin deficite motorii sau activarea anormală a sistemului motor, ceea ce duce la rigiditate, tremor și mișcări involuntare (Fig. 3).
Necroză ganglionară bazală.
Scăderea producției de ATP care apare în acest sindrom nu se limitează la afectările sale asupra sistemului nervos central, consecințele acestei scăderi a energiei se reflectă în manifestările clinice ale sindromului Leigh.
Convulsii, întârziere psihomotorie, atrofie optică, hipotonie, slăbiciune, letargie, vărsături, mișcări anormale (ataxie, tremor), iritabilitate, pierderea vederii și anomalii respiratorii 3 .
Moștenirea sindromului Leigh
Deși mitocondriul are propriul ADN, acesta nu este independent de participarea ADN-ului nuclear, deoarece ambii participă la codificarea subunităților care alcătuiesc fiecare dintre complexele enzimatice ale lanțului respirator, cu excepția complexului II. codificat exclusiv de ADN nuclear, de aceea, în funcție de complexul afectat și de codificarea acestuia, tipul de moștenire poate fi: matern, în cazul mutațiilor ADN-ului mitocondrial sau autosomal recesiv, atunci când mutațiile apar în ADN-ul nuclear 5 .
Cele mai raportate cazuri de sindrom Leigh au fost identificate prin mutații ale ADN-ului mitocondrial, a cărui genă codifică una dintre subunitățile ATPazei, motiv pentru care prezintă o moștenire maternă, pe de altă parte, mutații în ADN-ul nuclear care afectează sindromul Complex IV prezintă moștenirea autosomală recesivă. Frecvența de prezentare a acestui sindrom este de 1 din 36.000 de nașteri.
Diagnosticul și tratamentul
Manifestările clinice ale sindromului apar înainte de vârsta de 6 luni, medicul care evaluează cazul necesită o mare abilitate pentru a putea diferenția această tulburare de alte tulburări mitocondriale care prezintă caracteristici similare și cu care se poate confunda, pentru un diagnostic Diferențial adecvat ar trebui să fie folosit de resurse precum; Biopsie musculară pentru a analiza funcționarea lanțului respirator și pentru a putea identifica eroarea în complexele enzimatice, precum și utilizarea rezonanței magnetice și a tomografiei computerizate care permite identificarea necrozei ganglionilor bazali, principala caracteristică a Leigh sindrom.
Tratamentul după diagnosticul acestui sindrom este paliativ, implementarea unei diete ketogenice atunci când sindromul este asociat cu deficit de piruvat dehidrogenază poate să nu reflecte niciun beneficiu, din cauza lipsei unui tratament eficient care să permită reducerea daunelor, speranța de viață a unui copil cu acest sindrom nu depășește 2 ani.
Nu s-a primit nicio sponsorizare pentru realizarea acestui articol.
Conflict de interese
Autorul nu declară niciun conflict de interese.
Dr. Aurelio Mendoza Medellin, profesor al unității de învățare Biochimie a Facultății de Medicină a Universității Autonome din Statul Mexic, pentru cunoștințele care au influențat realizarea acestui articol.
- S; Sindromul Leigh cu d; deficit de complexe I; III și IV ale lanțului respirator mitocondrial
- TRATAMENTUL BOLII HIRSCHSPRUNG, JURNAL DE MEDICINĂ
- Journal of Holistic Medicine Complementary Medicines Nº53
- Revista de cercetare personală Autonomie
- Riscul dietei; pentru prezența dislipidemiilor la școlari Revista de Medicina e