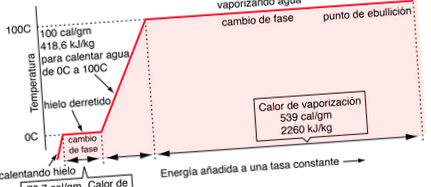
Tranzițiile între fazele solide, lichide și gazoase includ de obicei cantități mari de energie, în comparație cu căldura specifică. Dacă la o masă de gheață, adăugăm căldură la o rată constantă, pentru a o transporta prin schimbările de fază, mai întâi în lichid și apoi în vapori, energiile necesare pentru realizarea fazei se schimbă (numită căldură latentă de fuziune și căldură latentă a vaporizare), ar da naștere platourilor pe care le observăm în graficul de temperatură vs timp de mai jos. Presiunea din grafic se presupune a fi 1 atmosferă standard.
| Scale de temperatură | Modificări ale fazei apei | Punct de fierbere |
| Apă |
Datele privind modificarea fazei de vaporizare sunt luate la o presiune de 1 atmosferă standard.
Studiind energia schimbărilor de fază din apă, constatăm că energia potențială este tratată ca o cantitate negativă. Analogia cu un sistem mecanic care are energie potențială gravitațională și energie cinetică ne poate ajuta să înțelegem logica acestei cantități de energie negativă. Suntem întotdeauna liberi să alegem zero de energie potențială și pare logic să alegem acest zero de energie potențială, astfel încât o moleculă liberă în repaus să aibă energie zero. O particulă legată în repaus are energie potențială negativă.
| Modificări ale fazei apei |
Se știe că trebuie să adăugăm 100 de calorii de energie pentru a crește temperatura de 1 gram de apă de la 0 ° la 100 ° C. O parte din această energie crește energia cinetică a moleculelor, iar o altă parte se adaugă la energia potențială.
Mărimile blocurilor care reprezintă energia cinetică a moleculelor la 0 ° C și la 100 ° C ne oferă o ilustrare vizuală a semnificației temperaturii și a naturii scării absolute sau a temperaturii Kelvin. Din definiția temperaturii cinetice, se vede că dimensiunea blocului este proporțională cu temperatura, iar raportul înălțimilor blocurilor CE (energie cinetică) este raportul temperaturilor. Dar temperatura cinetică este inerent o temperatură absolută, deci raportul de înălțimi al blocurilor este de 373K/273K. Prin urmare, temperatura absolută este de fapt proporțională cu energia cinetică de translație a moleculelor, în timp ce temperaturile Celsius sunt alese pentru comoditate.
În procesul de încălzire a apei de la 0є la 100є C., s-au adăugat 100 de calorii de energie. O parte din această energie a crescut energia cinetică a moleculelor, iar unele au adăugat la energia potențială. Pentru a evalua cantitatea adăugată la energia cinetică, vitezele moleculare la cele două temperaturi trebuie evaluate cu ajutorul distribuției vitezei Boltzmann.
Câștigul net în energie cinetică, atunci când apa este încălzită de la 0є la 100є C., este apoi de 16,7 calorii/gram. Restul energiei va slăbi forța de atracție dintre moleculele de apă. Această slăbire a forțelor intermoleculare se manifestă prin reducerea tensiunii superficiale a apei calde.
În procesul de vaporizare a apei, trebuie adăugată o cantitate mare de energie pentru a depăși forțele de coeziune rămase între molecule. O parte suplimentară a acelei energii este transformată în lucru PdV pentru a extinde gazul de la volumul său foarte mic de lichid la volumul vaporilor rezultați.
Dacă căldura de vaporizare a apei la 100 ° C este de 539 de calorii, atunci, scăzând componenta de lucru de 41 de calorii, sugerează că consumul real de energie de legare a moleculelor de apă la 100 ° C este de 539-41 = 498 de calorii.
De ce, căldura vaporizării este mai mare în corpul uman?
O caracteristică interesantă a procesului de răcire a corpului uman prin evaporare este că căldura extrasă prin evaporarea unui gram de sudoare din pielea umană la temperatura corpului (37 ° C.), este citată în cărțile de fiziologie ca 580 de calorii/g., în loc de 540 calorii nominale/g. la punctul de fierbere normal. Întrebarea este, de ce este mai mare decât temperatura corpului.
Principala parte a răspunsului este că energia de legare a moleculelor de apă este mai mare la o temperatură mai scăzută și, prin urmare, are nevoie de mai multă energie pentru a le separa și a le aduce la starea gazoasă. Modificarea căldurii de vaporizare poate fi calculată mai mult sau mai puțin, folosind ceea ce știm despre apă (căldura specifică a apei, 1 calorie/gm ° C.). Este nevoie de 37 de calorii pentru a încălzi un gram de apă de la 0 ° C la 37 ° C, dar schimbarea energiei cinetice este mult mai mică decât:
S-a demonstrat anterior că atunci când apa este încălzită de la zero la 100 ° C, energia cinetică a moleculelor de apă crește doar cu 61,7 - 45 = 16,7 calorii/g. Dar știm că sunt necesare 100 de calorii pentru a încălzi. Prin urmare, contribuția la slăbirea legăturilor de apă este de 83,3 cal/g. Folosind rezultatul apei la 37 ° C, este evident că trebuie furnizate 52,4 calorii de energie suplimentară, pentru a evapora apa la 37 ° C.
Există un element suplimentar în modelarea căldurii de vaporizare la temperatura corpului - lucrarea PdV necesară pentru a aduce apa în stare gazoasă este puțin mai mică de 37 ° C. Prin analogie cu calculul muncii de mai sus, acea muncă sa dovedit a fi cu 34,2 calorii/g, cu 6,8 calorii/g mai mică decât la 100 ° C.
Deci, acest model sugerează o căldură de vaporizare la 37 ° C.:
Căldura de vaporizare la temperatura corpului = 539 cal/gm + 52,4 cal/gm - 6,8 cal/gm = 585 cal/gm.
Deci, acest model simplu este destul de bun conform citatului 580 cal.
- Natrol, Carb Intercept cu Faza 2 Carb Controller, 1.000 mg, 60 Capace Veggie - iHerb
- Curățare clasică a feței - Nina Merli Beauty Center
- Antrenor personal pentru a slăbi în DonostiaSan Sebastiбn
- Madero se retrage din evenimentul PAN cu strippers
- Antrenament personal cu fitness și nutriție sportivă - Orthos
- Săruturile ameliorează durerea și ard calorii - nu știi nimic!
- Postul intermitent nu este recomandabil pentru persoanele cu diabet zaharat de tip 2 Farma Salud Y
- Utilități de drenaj limfatic
- Coca Cola Bubbles cu stevia toate încercările frustrate de a oferi băuturi răcoritoare fără zahăr
- Ntrax, virusul mortal care afectează deja prima pagină a Chinei și Franței