Ce sunt selenoproteinele?
Selenoproteinele sunt un grup exclusiv de proteine care includ în structura lor un rest de selenocisteină (Sec), considerat aminoacid numărul 21 din codul genetic. Acest aminoacid neobișnuit este un analog al cisteinei (Cys) și conține seleniu în loc de sulf. Seleniul este un micronutrient esențial în multe organisme și deficiența sa a fost asociată cu numeroase afecțiuni fiziopatologice, cum ar fi bolile cardiovasculare, tulburările neuromusculare, cancerul sau inflamația (Vyacheslav M et al, 2014).
Reziduurile Sec și Cys ocupă poziții omoloage, cu toate acestea Sec este un aminoacid mai reactiv decât cisteina și face parte din domeniul catalitic al proteinei. În selenoproteinele cu funcție cunoscută, este întotdeauna implicată în reacțiile redox. Din punct de vedere evolutiv și datorită similitudinii proprietăților lor chimice, a existat o evoluție specifică a liniei de la Sec la Cys și, prin urmare, este posibil să se găsească omologi ai selenoproteinelor care încorporează Cys în loc de Sec, definindu-se ca fiind ortologi sau gene paralogice (Zhang Y și colab., 2006).
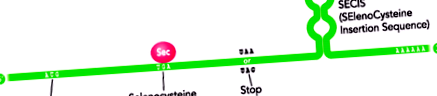
Incorporarea Sec în lanțul polipeptidic este determinată de codificarea acestuia de către codonul UGA, un codon care specifică de obicei terminarea traducerii proteinelor. Apare atunci când există o structură conservată în buclă stem în regiunea 3'-UTR a ARNm a selenoproteinelor, cunoscut sub numele de element SECIS (SElenoCysteine Insertion Sequence) (Lobanov AV at al, 2009) (Figura 1).
figura 1. Reprezentarea schematică a structurii ARNm a unei selenoproteine. Se observă dualitatea codonului UGA, codificând, pe de o parte, aminoacidul Sec și, pe de altă parte, indicând finalizarea traducerii. În regiunea 3 'UTR, prezența elementului SECIS iese în evidență cu o structură de buclă conservată (modificată din Moghadaszadeh B și colab., 2006).
Biosinteza selenoproteinelor
Selenoproteinele se caracterizează prin conținerea aminoacidului Sec. Acest reziduu este codificat de codonul UGA (de obicei un codon STOP) prezent în cadrul de citire deschis al genei, care este decodificat ca Sec în timpul sintezei proteinelor ribozomale dintr-un mecanism specific montat pe translația canonică aparat. Semnalul principal care direcționează recodificarea codonului UGA este o structură secundară prezentă exclusiv în transcrierile selenoproteice, elementul SECIS. Adică elementul SECIS este cel care dezambiguizează semnificația codonului UGA și activează mașina de inserare Sec.
Sec este singurul aminoacid a cărui sinteză are loc în propriul său ARNt (nu există sinteză de aminoacizi liberi), numit ARNt [Ser] Sec. Acest ARNt este aminoacilat cu o serină într-o reacție catalizată de seril-ARNt sintetaza (SerS) pentru a da naștere la structura de bază pentru biosinteza sec. Va exista apoi o fosforilare a serinei prin fosfoseril-ARNt kinază (PSTK). La rândul său, seleniul este forforilat de selenofosfat sintetaza 2 (SPS2) și este adăugat serinei deja fosforilate. Pe această structură Sec sintetaza (SecS) produce reziduul Sec formând astfel Sec-tRNA [Ser] Sec (Bellinger FP și colab., 2009) (Figura 2).
Figura 2. Mecanismul sintezei Sec. SerS aminoacilează ARNt [Ser] Sec cu serină din SerS, dând naștere Ser-ARNt [Ser] Sec. Acesta din urmă este fosforilat de PSTK, care furnizează substratul SecS împreună cu seleniu fosforilat pentru sinteza Sec-tRNA [Ser] Sec (modificat din Labunskyy VM și colab., 2014).
Pentru încorporarea Sec-tRNA [Ser] Sec în ribozom, acesta trebuie recunoscut de un factor de alungire specific numit EFSec. EFSec nu interacționează direct cu elementul SECIS, ci mai degrabă prin proteina care leagă SECIS, cunoscută sub numele de SBP2. În plus, alți factori, cum ar fi proteina ribozomală L30 (care este un factor de inițiere a traducerii eucariote, numit și eIF4a3) participă la procesul de includere a Sec ca răspuns la prezența codonului UGA în cadrul de citire al genei (Bellinger FP și colab., 2009) (Figura 3).
Figura 3. Mecanismul de inserție a Sec în lanțul polipeptidic. Elementul SECIS este un intermediar al asamblării factorilor EFSec, SBP2 și L30 la ARNm de selenoproteine permițând încorporarea Sec ca răspuns la prezența codonului UGA (modificat din Labunskyy VM și colab., 2014).
Similitudinea globală a mecanismului de sinteză și încorporare a Sec în cele trei domenii ale vieții sugerează că acest fenomen a apărut o singură dată în evoluție, înainte de separarea acestor domenii. Existența unor linii care nu încorporează Sec indică faptul că, în unele cazuri, această capacitate ancestrală a fost pierdută și acest lucru susține ideea că există diferite presiuni selective care determină menținerea sau pierderea încorporării Sec.
Familiile selenoproteice
Efectele biologice ale seleniului sunt mediate în principal de selenoproteine, care sunt prezente în arhee, bacterii și eucariote. Cu câteva excepții, aminoacidul Sec este situat în centrul activ al enzimei, unde mediază reacțiile de cataliză redox (Arnér ES, 2010). Din acest motiv, rolurile fiziologice pe care le adoptă selenoproteinele depind în mare măsură de prezența Sec, astfel încât mutațiile specifice care afectează respectivul aminoacid pot declanșa cu ușurință inactivarea acestuia.
Clasificarea selenoproteinelor în familii depinde de localizarea Sec în lanțul de aminoacizi (Figura 4). Pe de o parte, un prim grup este format din acele familii care au Sec în apropierea capătului C-terminal al proteinei. Este alcătuită, de exemplu, din tioredoxin reductaze (TrxRs) și selenoproteine S, I, O și K. Pe de altă parte, poziția Sec la capătul N-terminal formează un al doilea grup în care glutation peroxidazele (GPxs), iodotironină deodinaze (DIO), selenoproteine H, M, N, T, V și W și selenofosfat sintetaza 2 (SPS2) (Lu J și Holmgren A, 2009).
Deși căile moleculare prin care selenoproteinele își îndeplinesc rolurile biologice diferite sunt foarte diverse și, în multe cazuri, necunoscute, majoritatea acționează ca enzime antioxidante extrem de eficiente care fac parte din sistemele de tioredoxină și glutation (Kryukov GV și colab., 2003). Aceste sisteme mențin homeostazia redox a celulelor în detrimentul puterii de reducere a NADPH și participă, printre alte procese fiziologice, la metabolismul hormonilor tiroidieni, la maturizarea spermei și a funcției musculare (Labunskyy VM et al, 2014).
Figura 4. Clasificarea și funcțiile diferitelor familii de selenoproteine. O diagramă a lungimii relative a fiecărui tip de selenoproteină este prezentată în dreapta, iar locația Sec este marcată cu roșu (Labunskyy VM și colab., 2014).
Evoluția selenoproteinelor
Selenoproteomul este setul de selenoproteine ale unui organism și evoluția acestuia este definită de condițiile de mediu în care trăiesc organismele, precum și de disponibilitatea seleniului (Lobanov AV at al, 2009). De exemplu, organismele acvatice se caracterizează prin prezența celor mai mari selenoproteomi. Dimpotrivă, la organismele terestre cantitatea de selenoproteine este semnificativ mai mică. Una dintre cele mai importante ipoteze pentru a explica această situație este că funcția antioxidantă a selenoproteinelor joacă un rol cheie în protecția celulelor împotriva concentrațiilor ridicate de oxigen (Jakupoglu C și colab., 2005). Una dintre implicațiile tranziției către habitatul terestru este accesul limitat al mai multor elemente esențiale, cum ar fi seleniul, care este în mod special mai mic. Ca urmare, multe organisme terestre, cum ar fi plantele superioare, drojdiile, ciupercile și anumite specii de animale, pierd familiile de selenoproteine sau le înlocuiesc cu omologi care conțin cisteină (Lobanov AV și colab., 2009).
Majoritatea selenoproteinelor identificate au o origine ancestrală și au fost generate în principal pe parcursul evoluției din duplicarea genelor. Adnotarea genomelor, aplicarea metodelor bioinformatice pentru predicția noilor selenoproteine și modelele de reconstrucție filogenetică au permis caracterizarea a 45 de familii de selenoproteine la vertebrate, dintre care 20 sunt generate din duplicarea unei selenoproteine existente și 6 fac parte din selenoproteom ancestral (Mariotti M și colab., 2012) (Figura 5). Același studiu concluzionează că selenoproteomul mamiferelor a rămas relativ stabil și este alcătuit dintr-un total de 28 de familii, cu până la 25 de gene care codifică selenoproteinele pentru fiecare specie de mamifer. La fel, 21 de selenoproteine comune sunt identificate la toate vertebratele, în timp ce restul se găsesc doar în anumite linii. Aceasta arată originile posibile ale selenoproteinelor, inclusiv duplicarea genelor și substituirea cu cisteină.
Figura 5. Evoluția selenoproteomului vertebratelor. Selenoproteinele ancestrale sunt indicate în roșu și modificările lor evolutive sunt reflectate de arborele filogenetic. Aceste selenoproteine subliniate sunt unice pentru vertebrate, în timp ce culoarea verde indică formarea unei noi selenoproteine prin duplicarea genelor. Selenoproteinele pierdute de-a lungul liniei sunt prezentate în gri și cazurile în care a avut loc o înlocuire cu un omolog cu cisteină sunt indicate în albastru (Mariotti M și colab, 2012).
Adnotare și predicție
În concluzie, analiza genomilor secvențați care permit analiza prezenței și distribuției selenoproteinelor împreună cu studiul detaliat al filogeniei lor, va conduce la o mai bună înțelegere a funcției și implicației selenoproteinelor în fiziologia și patologia umană.
Macaca nemestrina
Macacul sudic cu coadă de porc (Macaca nemestrina) este o specie de primat de catarină din familia Cercopithecidae. Locuiește în Peninsula Malay, Borneo, Sumatra și Insula Bangka. Este un macac de dimensiuni medii, omnivor, care trăiește în principal în păduri, dar odată cu înaintarea oamenilor, se găsește și în plantații și grădini. Anterior, subspeciile acestui taxon sunt acum specii: Macaca leonina (macac cu coadă de porc nordic), Macaca pagensis (macacul Pagai) și Macaca siberu (macacul Siberut). Pentru mai multe informații, faceți clic aici.
- Tatuajele o modă care dăunează pielii
- Șahtior - Real Madrid Madrid se scufundă și va suferi până la final - Liga Campionilor
- Ce este un saltea și pentru ce este MOBliving?
- Shakira părăsește clinica în care a născut - Supersport
- Retrospector, guvernul francez caută din nou mașina viitorului