Dr. Kepa Balparda prezintă cazul unui pacient în vârstă de 36 de ani care a fost operat cu doi ani mai devreme, în Panama, pentru a schimba culoarea irisului. Dispozitivul care a fost implantat a fost „New Color Iris Implant”. Aveam o istorie a LASIK în ambii ochi, acum 15 ani.
După dezvoltarea glaucomului și a decompensării corneene, implanturile au fost îndepărtate, o intervenție chirurgicală care a fost efectuată în Columbia.
În momentul în care a mers la doctorul Balparda pentru o a doua opinie, avea glaucom și edem corneean. A fost tratat cu timolol/dorzolamidă/brimonidină.
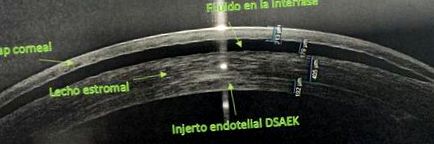
Dr. Balparda a efectuat o intervenție chirurgicală lamelară de tip DSAEK la ochiul drept, cu o evoluție inițială bună, dar în perioada postoperatorie timpurie, lichidul a început să se acumuleze în interfață (Imagine).
El a întrerupt tratamentul cu steroizi și a adăugat latanoprost și acetazolamidă orală la tratamentul anterior antiglaucom, fără a prezenta îmbunătățiri. El a decis să ridice clapeta pentru ao repoziționa, o tehnică care a avut inițial succes până după 72 de ore postoperatorii, lichidul a început să se acumuleze din nou la interfață.
Opțiunile terapeutice care au fost propuse:
- Suspendați corticosteroizii: așa cum a făcut deja dr. Balparda
- Tratament medical pentru glaucom: încercarea de a evita inhibitorii anhidrazei carbonice pentru a evita alterarea endotelială
- Trabeculoplastie selectivă cu laser (STL)
- Operație de filtrare: trabeculectomie vs valva lui Ahmed
INTRODUCERE
Keatomileuza asistată de laser (LASIK) este cea mai largă tehnică de refracție realizată astăzi. (1) Se estimează că peste 16 milioane de persoane au efectuat această procedură de la introducerea sa în 1990. (2) Popularitatea tehnicii se datorează eficacității, siguranței, stabilității și predictibilității excelente în tratamentul ambelor miopii, cum ar fi ca hipermetropie, asociată sau nu cu astigmatismul. (3,5)
De-a lungul timpului, rezultatele s-au îmbunătățit ca urmare a progreselor tehnologice. (4,6) Mai presus de toate, crearea clapetei corneene care a trecut de la realizarea cu un mircokeratometru mecanic (MK) la realizarea cu un laser femtosecund (LFS). LFS pare să ofere avantaje față de MK, cum ar fi posibilitatea de a crea un lambou mai subțire, mai uniform și mai precis, reducând complicațiile intraoperatorii și postoperatorii. (1)
Printre complicațiile care pot apărea după intervenția chirurgicală LASIK se numără cele legate de lambou, creșterea epitelială la interfață, cheratită lamelară difuză, infecții, abcese la interfață sau acumularea de lichid la interfață, denumită și sindrom fluid. Interfața (SFI) . (7,8,9)
De la descrierea sa în 1999 de către Lyle și Jin, (12) SFI a primit multe nume din cauza lipsei de cunoștințe despre etiologia și patogeneza sa; Cheratita stralomă intralamelară indusă de presiune, cheratopatia lamelară indusă de steroizi și cheratopatia stromală intralamelară au fost denumiri utilizate pentru denumirea acestei entități. Toate acestea reprezintă, așa cum se arată în studiul lor de Dawson și colab., Semne și simptome ale IFS în etape diferite, dar aparținând aceluiași proces. (11) În 2012, Galvis V și colab. Au propus denumirea de keratopatie indusă de edem post-LASIK (PELK) pentru această entitate (10), unde termenul indus de presiune nu a fost inclus, deoarece nu este produs doar de un IOP crescut dar pentru orice patologie care cauzează edem cornean post-LASIK. De asemenea, termenul „fluid” nu este inclus, deoarece atunci când examinăm lampa cu fantă nu găsim întotdeauna un fluid evident.
IFS se caracterizează prin acumularea de umor apos în spațiul intrastromal care apare de obicei între prima săptămână și câteva luni-ani după operație. (12) Poate fi cauzată de o creștere a PIO la pacienții care răspund la corticosteroizi, disfuncție endotelială anterioară, uveită, traume endoteliale sau corneene. (13,14,15)
Din punct de vedere clinic, putem observa o ceață difuză, non granulară, limitată la zona centrală a LASIK. Această ceață poate fi ușor confundată cu ceața granulară observată în cheratita lamelară difuză, care, spre deosebire de SFI, este mai frecventă clinic și apare de obicei înainte de săptămâna postoperatorie. (unsprezece)
În lampa cu fantă, putem observa un spațiu ocupat de fluid între lamboul cornean și stroma reziduală care poate fi confirmat de OCT-SA. Dawson și colab. (11) au efectuat o etapizare în conformitate cu caracteristicile observate în lampa cu fantă:
Ilustrația 3. Clasificarea propusă de Dawson și colab. SFI produs de presiune crescută sau daune endoteliale.
- Etapa 1: exsudare ușoară până la moderată a interfeței fără ceață apreciabilă.
- Etapa 2: exsudație moderată-severă din interfața asociată cu o ceață difuză, moderată-severă, nu granulară și, uneori, un mic buzunar de lichid.
- Etapa 3: o pungă mare și difuză de fluid confluent care se colectează între clapeta LASIK și patul stromal rezidual.
Diferitele etape fac parte din caracteristicile clinice pe care le putem observa în corneea operată cu LASIK, în funcție de severitatea și durata edemului corneean și de mecanismul care a cauzat-o. (unsprezece)
În cazurile cauzate de o creștere a IOP, este de obicei scăzută în mod fals, deoarece măsurăm presiunea care există la interfață. (16) Pentru a face o măsurare mai aproximativă a presiunii reale, ar trebui să luăm presiunea la nivel periferic, așa cum sugerează Dr. Oscar Albis și Dr. Jorge Pacheco. (17)
Conform studiilor publicate, există controverse în corelația dintre PIO centrală și periferică atât la pacienții supuși unei intervenții chirurgicale refractive, cât și la cei care nu au fost operați. (17) Unele studii spun că măsurarea în partea temporală a corneei este similară cu cea centrală înainte de operație, deci ar putea fi o măsurare fiabilă la pacienții operați. (18) Alte studii au observat diferențe între 1,0-2,8 mmHg centru-periferic la pacienții operați cu LASIK. Această diferență ar putea fi legată de o scădere a rezistenței corneei la indentare, fie datorită subțierii stromei corneene, fie datorită ablației membranei bowman. (19)
Implanturile Iridian au fost proiectate în 1956 cu intenția de a corecta defectele congenitale sau traumatice ale irisului (aniridia, colobomul irisului, albinismul ocular etc.) pentru a reduce strălucirea și sensibilitatea la lumină. (24)
Printre complicațiile legate de implanturile cosmetice NewIris au fost raportate: edem cornean, hipertensiune oculară (OHT), dispersie pigmentară, uveită, scăderea numărului de celule endoteliale, sindrom Uveită-Glaucom-Hifem (UGH), neuropatie optică glaucomatoasă, rețea și formare trabeculară de sinechii anterioare. Aceste complicații au fost propuse de Dr. Dante Buonsanti și Dr. Luis W LU. (20,21,22,23) În 2012, medicii Rupa D. Shah și J. Bradley Randleman au scris editurii Elsevier avertizând despre complicațiile grave pe care le cauzau dispozitivele NewColorIris Implants. (25)
Dr. Garcia-Pous, de la Universitatea din Valencia, a publicat cazul unei tinere de 21 de ani care a suferit o intervenție chirurgicală estetică pentru a schimba culoarea irisului, în Panama. (21) După operație, pacientul a dezvoltat glaucom și decompensare a endoteliului corneean care ar putea fi rezolvată prin tratament medical și îndepărtarea implantului de iris. În imaginile publicate în acest articol putem vedea cum arată implantul NewIris (figura). În OCT-SA am observat cum, în acest caz, a fost în contact direct cu endoteliul cornean și a obstrucționat rețeaua trabeculară. (douăzeci și unu)
Ilustrația 4. Imagine publicată în articolul de Dr. García-Pous. Se afișează forma dispozitivului NewIris. Implant de silicon cu diametru de 11-13 mm cu deschidere pupilară de 3,5 mm și 0,16 mm grosime. Proiectat pentru a fi implantat în camera anterioară. Ilustrația 5. Tomografia de coerență optică a camerei anterioare care prezintă implantul NewIris sprijinit pe iris și în contact cu rețeaua trabeculară.
În prezent, aceste dispozitive sunt implantate doar în Panama, fără a fi aprobate de FDA în Statele Unite sau de marcajul CE în Europa. (25) Prin urmare, este important să fim atenți la posibilii pacienți care pot apărea în consultația noastră.
Printre posibilele opțiuni terapeutice care au fost ridicate în forum, găsim următoarele:
În primul rând, corticosteroizii trebuie eliminați la pacienții cu răspuns cortico, pentru a evita creșterea presiunii intraoculare, așa cum a făcut dr. Balparda. Acest lucru este foarte important, deoarece, după cum știm, majoritatea pacienților supuși unei intervenții chirurgicale refractive sunt miopi și sunt mai predispuși la dezvoltarea OHT după tratamentul cu steroizi. (17)
În al doilea rând, am opta pentru tratament medical antiglaucomatos dacă nu s-a obținut o scădere a PIO după retragerea corticosteroizilor, încercând să evităm utilizarea inhibitorilor de anhidrază carbonică (IAC), așa cum a subliniat dr. Luis W LU și ca cel mai important forum medici. IAC-urile sunt capabile să reducă formarea ionilor de bicarbonat în celulă, reducând transportul asociat de sodiu și apă și astfel pot produce edem corneean la ochi cu funcție endotelială slabă și pot întârzia expulzarea lichidului stromal. (29,30)
În al treilea rând, trabeculoplastia selectivă cu laser a fost propusă ca etapă intermediară până la intervenția chirurgicală definitivă.
Filtrarea operației ar fi ultimul pas în tratamentul glaucomului necontrolabil.
Într-un studiu recent, s-a făcut o analiză retrospectivă pe 87 de ochi implantate cu două tipuri de dispozitive de schimbare a culorii irisului (New Color Iris și Bright Ocular), ambele fără aprobarea FDA sau marcajul CE. 92,3% din ochii operați au avut cel puțin o complicație (31), dintre care 54,1% au dezvoltat OHT, majoritatea necesitând terapie cvadruplă și tratament sistemic. Cincisprezece ochi (23,1%) din acest studiu au trebuit să fie supuși unei intervenții chirurgicale de filtrare. (31) Această opțiune a fost cea mai recomandată de medicii forumului și cea mai practicată în cazuri similare cu cea prezentată. (16,34,35)
Este important să căutați o cauză secundară a IFS, cum ar fi o decompensare endotelială anterioară, deși acest lucru inițial în cazul nostru a fost exclus de chirurgia laminară (DSAEK) efectuată de Dr. Balparda sau uveita, care, ca studiu spectacolele realizate de Dr. El Chebab și colab. ar putea fi prezente la aproape 40% dintre pacienții care au implantat acest tip de dispozitiv. (31)
Dr. Balparda a întrebat despre amputarea clapetei:
Deși aceasta este o tehnică care este rezervată ca ultimă soluție și pentru pacienții refractari la tratament conservator, ar putea fi utilă în cazuri complicate care nu răspund la tratament. (32) Scopul amputării lamboului este de a permite noului epiteliu să acopere patul stromal expus și să creeze o suprafață regulată, similară corneei care rămâne după o keratectomie fotorefractivă (PRK). Această nouă suprafață ar trebui să asigure o refracție stabilă și o acuitate vizuală corectă. Opțiunea de a elimina clapa nu ar fi o soluție definitivă pentru cazul prezentat, deoarece așa cum este descris de Dr. Galvis V, IFS este secundar edemului corneean produs de OHT.
Puncte importante
- Fiți atenți la pacienții cu implanturi cosmetice iridiene, din cauza complicațiilor pe care le pot dezvolta în viitor; decompensare corneeană datorată pierderii celulelor endoteliale, uveită, neuropatie optică glaucomatoasă etc. (2. 3)
- Etiopatogeneza IFS se poate datora oricărui proces ocular care produce edem corneean. Deoarece nu este o boală inflamatorie, tratamentul cu corticosteroizi nu este indicat și ar putea agrava starea. (10)
- Diagnosticul întârziat al IFS poate duce la pierderea ireversibilă a vederii. (13)
Această boală trebuie întotdeauna luată în considerare, atunci când apare o ceață difuză, căutați fluid la interfață și luați presiunea intraoculară în periferie, spre deosebire de cheratita laminară difuză în care ceața rămâne în zona optică tratată, în SFI aceasta se extinde pe tot parcursul corneea. (10,16)
- Dacă îți urăști fosta, este posibil să suferi de acest sindrom
- Journal of Primary Care Pediatrics - Sindromul de hipomineralizare incisiv-molar
- Ce ne spune culoarea menstruației de la maro la roz - MALVESTIDA
- Sindromul constituțional și insuficiența respiratorie
- Sindrom de sevraj de marijuana Recuperare Centro
