- Subiecte
- rezumat
- Introducere
- Rezultate
- Proiectarea rațională a unui nou ligand pentru studii structurale.
- Arhitectura generală a SMO umane multidominiale
- Interacțiune multi-domeniu unică
- Compararea SMO uman cu alți receptori din clasa frizz
- Discuţie
- Metode
- Sinteza TC114
- Construcție de fuziune SMO-FLA concepută pentru studii structurale
- Exprimarea și purificarea proteinei de fuziune SMO-FLA
- Cristalizarea în LCP pentru colectarea de date sincrotrone
- Colectarea datelor sincrotronei și determinarea structurii
- Cristalizarea în LCP pentru colectarea datelor XFEL
- Colectarea datelor XFEL și determinarea structurii
- Analiza spectrometriei de masă cu schimb de hidrogen-deuteriu
- Simulare MD
- Pregătirea proteinelor și construcția sistemului.
- Simulare dinamică moleculară și analiză de date.
- Test de semnalizare arici
- Analiza Western Blot
- Disponibilitatea datelor
- Informatie suplimentara
- Fișiere PDF
- Informatie suplimentara
- Fișier de evaluare inter pares
- Comentarii
Subiecte
- Biologia dezvoltării
- Nanocristallografie
rezumat
Receptorul netezit (SMO) aparține clasei Frizzled a superfamiliei receptorului cuplat la proteina G (GPCR), constituind o componentă cheie a căii de semnalizare Hedgehog. Aici prezentăm structura cristalină a SMO umane multidominiale, legată și stabilizată de un ligand instrument TC114 proiectat, utilizând o sursă laser cu raze X de electroni liberi de 2,9 Å. Structura dezvăluie o aranjare precisă a trei domenii distincte: un domeniu de helix transmembranar (TMD), un domeniu balama (HD) și un domeniu extracelular bogat în cisteină (CRD). Această arhitectură permite interacțiuni alosterice între domeniile care sunt importante pentru recunoașterea ligandului și activarea receptorilor. Prin combinarea datelor structurale, simularea dinamicii moleculare și analiza schimbului de hidrogen-deuteriu, demonstrăm că helixul transmembranar VI, bucla extracelulară 3 și HD joacă un rol central în transmiterea semnalului folosind un mecanism de declanșare. GPCR unic, distinct de alte domenii multiple GPCR-uri.
Introducere
Rezultate
Proiectarea rațională a unui nou ligand pentru studii structurale.
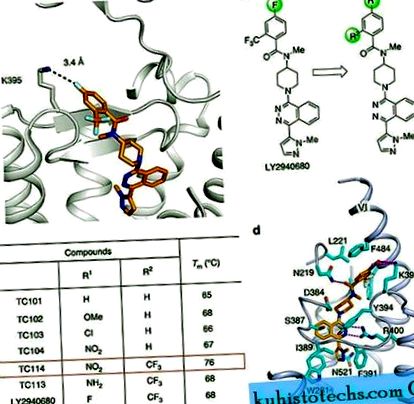
SMD trunchiat al CRD (ΔCRD-SMO) a fost anterior cristalizat cu mai multe molecule mici, inclusiv antagoniști și agoniști 3, 8, 9. Acești liganzi și alții nu au produs cristale ale SMO multidominial care conțin un CRD intact fără mutații stabilizatoare. Analiza structurilor anterioare ale ΔCRD-SMO 3, 8, 9 sugerează că cristalizarea unui SMO multi-domeniu ar putea necesita stabilizarea unor părți flexibile specifice ale structurii. De exemplu, am constatat că K395, situat în partea superioară a acului de păr β în bucla extracelulară 2, poate participa la interacțiuni cu reziduuri adiacente sau liganzi 3 și, prin urmare, adoptă probabil o stare conformațională dinamică (Fig. 1a). Prin urmare, presupunem că stabilizarea în continuare a acestei regiuni prin stabilirea unei interacțiuni definite și mai puternice ar putea reduce eterogenitatea conformațională.
( la ) Vedere de aproape a buzunarului de legare LY2940680 în structura ΔCRD - SMO (PBD ID: 4JKV). ( b ) Proiectarea și evoluția analogilor LY2940680 pentru studiul cristalizării prin variația substituenților pe inelul aromatic. ( c ) Valorile reprezentative ale Tm pentru LY2940680 și analogii săi conform testului de schimb de căldură CPM. ( d ) Vizualizare în prim plan a buzunarului de legare TC114. TC114 (carboni portocalii) și reziduurile SMO (carboni cian) implicați în legarea ligandului sunt prezentate în reprezentarea barelor. Receptorul este prezentat într-o reprezentare desen animat albastru deschis. Alte elemente sunt colorate după cum urmează: oxigen, roșu; azot, albastru închis; sulf, galben. Legăturile de hidrogen sunt prezentate ca linii magenta întrerupte.
Imagine la dimensiune completă
Analiza structurilor noastre SMO multi-domeniu a indicat faptul că grupul nitro introdus în ligand TC114 interacționează puternic cu K395 în SMO așa cum a fost proiectat și îmbunătățește stivuirea π - π între grupul benzoil și F484 în helix VI (Fig. 1d). Prin urmare, concluzionăm că TC114 stabilizează SMO-ul multidominant prin menținerea elicei VI într-o conformație stabilă care, la rândul său, îmbunătățește interacțiunea hidrofobă între ECL3 extins și canelura CRD hidrofobă. Prin urmare, ligandul proiectat TC114 a atins obiectivul dorit, acționând ca un agent de super stabilizare în testul de stabilitate termică și permițând studiul cocristalizării SMO multidominiale.
Arhitectura generală a SMO umane multidominiale
Structura generală a SMO (Fig. 2a; Fig. Suplimentară 4) împarte un pli canonic GPCR 7TM cu un helix VIII amfipatic care se desfășoară paralel cu planul membranei. CRD se așează în poziție verticală deasupra TMD și este susținut de bucla extracelulară 3 (ECL3) pe o parte și de o buclă de conectare (reziduurile 181–190) pe de altă parte. CRD și TMD sunt conectate prin HD (reziduurile 191-220). Mai mult, pe partea extracelulară a structurii (Fig. 2b), helixul VI se extinde dincolo de suprafața membranei în patru viraje α-elicoidale, iar partea superioară a helixului VI se înclină într-un viraj non-prolin spre CRD, ieșind în canelura sa hidrofobă și îmbinarea unei conexiuni cheie între CRD și TMD. CRD (reziduurile V107, L108, L112), HD (reziduul V210) și ECL3 (reziduurile V494, I496) formează un buzunar hidrofob (Fig. 2c). S-a raportat anterior că acest buzunar constituie un situs de legare a oxesterolului 7, 19 .
( la ) Structura globală a SMO umană în complex cu TC114 determinată într-un XFEL. TC114 este afișat ca bastoane portocalii. CRD, Linker, HD și TMD sunt indicate ca desen animat portocaliu, bleumarin, verde cian și respectiv albastru deschis. Limita membranei este marcată ca o linie punctată portocalie. Glicanii N-legați (NAG) sunt afișați în bare verzi. ( b ) Vedere de sus a SMO din partea extracelulară. Un buzunar hidrofob este format din canelura hidrofobă CRD și ECL3 (mâner marin). ( c ) Reziduurile cheie din CRD și ECL3 care definesc buzunarul hidrofob sunt afișate în bare cian și respectiv albastru deschis.
Imagine la dimensiune completă
Interacțiune multi-domeniu unică
Imagine la dimensiune completă
Compararea SMO uman cu alți receptori din clasa frizz
( la ) Vedere laterală a structurilor suprapuse ale CRD SMO umane (hSMO) cu CRD hFzd-4 (PDB ID: 5CL1) și mFzd-8 (PDB ID: 4F0A). SMO, hFzd-4 și mFzd-8 sunt prezentate ca desen animat în albastru deschis, verde lime și respectiv portocaliu. Wnt și Norrin sunt prezentate ca desene animate gri închis și respectiv galben portocaliu. Grupul palmitoil din mFzd-8 CRD este prezentat în sferele marine. ( b ) Site-ul 1: Vizualizare de aproape a grupului palmitoil cu reziduuri care interacționează, cum ar fi bastoane portocalii Grupul palmitoil este prezentat pe bețe marine. Reziduurile SMO care alcătuiesc buzunarul hidrofob sunt prezentate în bare albastre deschis, mFzd-8 în bare portocalii. ( c ) Site-ul 2: Suprafața SMO și hFzd-4 CRD. Norrin este prezentat într-un desen animat portocaliu deschis. Gradientul de culoare de la roșu deschis la roșu închis corespunde schimbării proprietății suprafeței de la hidrofil la hidrofob. Situl de legare Norrin de pe suprafața hFzd-4 CRD este marcat printr-un cerc punctat negru cu site-ul corespunzător marcat și pe suprafața SMO.
Imagine la dimensiune completă
Discuţie
Metode
Sinteza TC114
O soluție de acid 4-nitro-2- (trifluormetil) benzoic (80 mg, 0,34 mmol), amină secundară N-metil-1- (4- (1-metil-1 H-pirazol-5-il) ftalazină-1- il) piperidin-4-amină (100 mg, 0,31 mmol) și N, N-diizopropiletilamină (DIPEA, 60 mg, 80 μl, 0,46 mmol) în 3 ml de CH2Cl2 au fost tratați cu 1- [bis (dimetilamino)) metilen] -1H-1, 2, 3-triazolo [4, 5-b] piridiniu hexafluorofosfat de 3-oxizi (HATU, 153 mg, 0,40 mmol). Amestecul de reacție a fost agitat la temperatura camerei timp de 1 oră înainte de a fi stins prin adăugarea de saramură. Amestecul de reacție a fost extras de trei ori cu CH2CI2. Stratul organic combinat a fost spălat cu soluție saturată de NaHC03 și saramură secvențial, apoi uscat pe Na2S04. După filtrare, soluția a fost concentrată în vid și produsul brut a fost purificat prin cromatografie rapidă pe coloană pe silicagel pentru a se obține TC114, sub forma unui solid incolor (82 mg, 49%). Imagistica prin rezonanță magnetică nucleară a arătat un amestec de rotameri.
Construcție de fuziune SMO-FLA concepută pentru studii structurale
Gena SMO umană de tip sălbatic (WT) a fost sintetizată de Genescript și apoi clonată într-un vector pTT5 modificat conținând o casetă de expresie cu o secvență de semnal HA urmată de o etichetă FLAG, o etichetă 10 × His și un virus de gravură de tutun ( TEV)) site-ul de recunoaștere a proteazei la capătul N înainte de secvența receptorului și încă o etichetă His de 10 ori la capătul C. O mică proteină Flavodoxină (FLA, MW 16KD) 16 a fost fuzionată la ICL3 între P434 și S443, utilizând PCR stratificat. Terminalul N 1-52 și terminalul C 559-787 au fost trunchiate. O singură mutație E194M a fost introdusă în HD pentru construcție, ale cărei cristale au fost utilizate pentru colectarea datelor în XFEL. Construcția utilizată pentru determinarea structurii sincrotronului nu conține mutația punctuală și a fost ușor modificată prin trunchierea în continuare a capătului N-terminal la cinci reziduuri. Toate secvențele de grund utilizate în acest studiu sunt prezentate în Tabelul 1 suplimentar.
Exprimarea și purificarea proteinei de fuziune SMO-FLA
Cristalizarea în LCP pentru colectarea de date sincrotrone
Probele de proteine ale receptorului SMO dintr-un complex cu TC114 au fost reconstituite în fază cubică lipidică (LCP) prin amestecarea cu lipide topite (10% (g/g) colesterol, 90% (g/g) monoolein) într-un raport de 2/Proteină soluție 3 (v/v)/lipide folosind un mixer mecanic de seringă 29. Testele de cristalizare LCP au fost efectuate folosind un robot de cristalizare NT8-LCP (Formulatrix) în plăci sandwich din sticlă cu 96 de godeuri (Nova). După configurare, plăcile au fost incubate și imaginile au fost realizate la 20 ° C folosind o cameră/incubator de imagini automat (RockImager 1000, Formulatrix). Descoperirile inițiale ale cristalului au fost găsite într-o stare de precipitare conținând 100 mM citrat de sodiu dihidrat tribazic, pH 5,0, 30% (v/v) PEG400, 100 mM azotat de amoniu. După optimizare, cristalele au fost crescute în citrat de sodiu 100 mM dihidrat tribazic pH 5,0, 36% (v/v) PEG400, 50-200 mM azotat de amoniu până la dimensiunea medie de 47 × 23 × 8 μm 3 în decurs de 7 zile. Cristalele SMO au fost colectate direct din LCP folosind micromonturi de 30 μm (MiTeGen) și au fost congelate în azot lichid pentru colectarea datelor.
Colectarea datelor sincrotronei și determinarea structurii
Masă completă
Cristalizarea în LCP pentru colectarea datelor XFEL
Cristalele pentru LCP-XFEL au fost obținute în seringile etanșe la gaze Hamilton așa cum s-a descris mai sus 38 prin injectarea a 5 μl LCP încărcat cu proteine ca o coloană continuă de 400 μm în diametru într-o seringă de 100 μl umplută cu 60 μl de soluție precipitată conținând 100 mM citrat de sodiu dihidrat tribazic, pH 5,0, 36% (v/v) PEG400, 150 mM clorură de amoniu și incubat timp de cel puțin 24 de ore la 20 ° C. După formarea cristalelor (dimensiunea mediului 5 × 5 × 2 μm 3), probele de la 2 la 3 seringi au fost consolidate împreună și soluția de precipitare în exces a fost îndepărtată. Soluția precipitată reziduală a fost absorbită prin adăugarea câtorva microlitri de lipid MAG 7,9 topit 39. Proba LCP cristalină rezultată a fost inspectată la microscop vizual și încărcată într-un injector LCP 9 pentru colectarea datelor LCP-SFX.
Colectarea datelor XFEL și determinarea structurii
Analiza spectrometriei de masă cu schimb de hidrogen-deuteriu
Simulare MD
Pregătirea proteinelor și construcția sistemului.
Structura cristalină a receptorului SMO de colesterol a fost obținută din baza de date PDB (cod PDB: 5L7D 20). Lanțul A al structurii a fost selectat pentru a construi modelul. Prime 45 a fost utilizat în versiunea Schrödinger 2015-3 și ICL3 a fost construit prin modelul de omologie folosind o altă structură cristalină de la Smo (cod PDB: 4JKV (ref. 3)), iar Prime a prezis bucla ICL2. Modelul a fost rafinat de Prepwizard 46 la pH 7,0, iar terminalul C sau N a fost limitat de ACT și NME.
Membrana din jurul domeniului transmembranar al receptorului SMO a fost construită de 135 molecule POPC și 48 colesteroli utilizând serverul web CHARMM-GUI 47. Cutia sistemului limită periodică finală este de 84,75 × 84,75 × 139,85 Å și au fost folosite ape 20881 TIP3P și 62 Na + și 68 Cl - ioni (0,15 mol l -1 NaCl) pentru solvatarea și neutralizarea cutiei. Sistemul avea un total de 93.475 atomi pe celulă periodică.
Simulare dinamică moleculară și analiză de date.
Forța prezentată Amber99sb-ILDN 48 a fost aplicată receptorului SMO, apei TIP3P și ionilor, iar câmpul de forță Slipids 49 a fost aplicat colesterolului și POPC. Gromacs 5.1.2 (ref. 50) a fost utilizat pentru simulare, iar protocolul de relaxare a fost obținut de la CHARMM-GUI și descris pe hârtie și pe serverul său web. În primul rând, sistemul este minimizat cu 10.000 de pași prin cea mai abruptă procedură de coborâre și echilibrat la temperatură constantă (303,15 K) și presiune constantă (1,0 bar) în condiții de 50 ps NVT și 125 ps NPT cu restricții puternice asupra proteinelor și lipidelor și o nelegare limită de tăiere de 10-12 Å. Ulterior, s-a realizat un echilibru de 2 ns NPT în aceeași stare cu restricții slabe de proteine și lipide pentru a obține faza echilibrată. În cele din urmă, au fost efectuate două simulări MD identice ale produsului de 1.000 ns în receptorul SMO și colesterol ca ligand în sistemul lipidic și al apei.
Rezultatul simulării MD a produsului a fost analizat de Gromacs 5.1.2. Unghiul definit de trei atomi (C-alfa al lui P69, V210 și W535) a fost selectat pentru a descrie înclinația SMO CRD în raport cu SMO TMD.
Test de semnalizare arici
Celulele Light II (ATCC; Rockville, MD) cu expresie ectopică stabilă a 8 x luciferază de licurici la locul de legare Gli și construcțiile constitutive ale reporterului de luciferază Renilla au fost însămânțate în plăci cu 96 de godeuri. După transfecție cu plasmide mutante netede netede sau diferite de tip sălbatic, după cum s-a indicat, celulele au fost supuse la diferite tratamente, după cum s-a indicat timp de 36 de ore. Activitatea luciferazei în celulele ușoare II a fost măsurată folosind setul de sistem de testare a luciferazei Promega Dual (conform instrucțiunilor producătorului pe un luminometru (Dispozitive moleculare; Sunnyvale, CA)) (Madison, WI) și a fost normalizat la valorile Renilla. Datele au fost reprezentate grafic și valorile IC50 au fost determinate folosind GraphPad Prism. Fiecare punct de date reprezintă media ± sd repetată în triplicat.
Analiza Western Blot
Celulele după diferite transfecții, așa cum s-a indicat, au fost recoltate și supuse tampon de liză (50 mM Tris, pH 7,4, 150 mM NaCl, 1% NP-40, 1 mM vanadat de sodiu, 1 mM PMSF, DTT 1 mM, 10 mg ml -1 leupeptină și aprotinin), urmată de analiza imunoblot. Anticorpii primari împotriva SMO și GAPDH (Santa Cruz Biotechnology, Santa Cruz, CA, SUA) au fost utilizați pentru analiza imunoblotului conform procedurii de rutină 51. Anticorpii împotriva SMO și GAPDH sunt diluați 1: 200 și respectiv 1: 5.000, conform instrucțiunilor producătorului.
Disponibilitatea datelor
Coordonatele și factorii de structură au fost depuși în Protein Data Bank pentru SMO-TC114 rezolvat în XFEL (PDB: 5V56) și sincrotron (PDB: 5V57). Codurile de acces PDB 4JKV, 5L7D, 5L7I, 4QIM, 4QIN, 4N4W, 4O9R, 5KZZ, 5KZV, 5KZY, 5CL1, 4F0A au fost utilizate în acest studiu. Codurile de acces UniProt Q99835 pentru SMO umane au fost utilizate în acest studiu. Toate celelalte date sunt disponibile de la autorii corespunzători, la cerere rezonabilă.
Informatie suplimentara
Fișiere PDF
Informatie suplimentara
Cifre complementare, tabel complementar, metode complementare și referințe complementare.
Fișier de evaluare inter pares
Comentarii
Prin trimiterea unui comentariu, sunteți de acord să respectați Termenii și liniile directoare ale comunității. Dacă găsiți ceva abuziv sau nu respectă termenii sau liniile directoare, marcați-l ca inadecvat.
- Famagusta își redeschide stațiunea controlată de turci, în ciuda opoziției din Cipru
- Herbesan Bio Guarana Complex de ardere a grăsimilor 20 fiole de 15 ml
- Herbalife a lansat un complex multivitaminic cu 22 de vitamine și minerale esențiale - Știri
- Complexul de vitamine și minerale de Formula 2 - Acesta este site-ul unui membru Herbalife
- Hormon de creștere umană injectabil HGH pentru depozitare Melanotan 2 proaspăt uscat