Subiecte
rezumat
Introducere
Obezitatea a fost o problemă globală de sănătate atât în țările dezvoltate, cât și în țările în curs de dezvoltare, ceea ce nu este o strategie eficientă pentru a interzice prevalența acesteia. Potrivit Organizației Mondiale a Sănătății (OMS), dacă indicele de masă corporală (IMC) este egal sau mai mare de 25 kg/m 2, acesta este considerat a fi supraponderal, în timp ce dacă este egal sau mai mare de 30 kg/m 2, este considerat obezitate 1. În ultimul deceniu, tendințele bazate pe populație arată o creștere cu 40% a supraponderalității sau a obezității înainte de sarcină și o creștere de două ori a obezității morbide înainte de sarcină la femei 2. Pentru sistemul de reproducere uman, un IMC ridicat influențează negativ fertilitatea tulburărilor endocrine 3, anovulația 4 și scăderea calității ovocitelor 5, până la receptivitatea endometrială care ar putea induce rata avortului spontan 6. Prin urmare, tot mai multe femei cu IMC ridicat trebuie să apeleze la tehnologia de reproducere asistată (ART) pentru a-și rezolva infertilitatea.
Femeile cu un IMC ridicat au unele caractere similare cu femeile cu SOP, cum ar fi nivelul de progesteron inferior. Dacă protocolul PPOS combinat cu FET ar putea deveni o terapie adaptivă pentru femeile cu un IMC ridicat, acest lucru pare foarte plin de speranță și semnificativ. În special, uitați-vă la terapiile actuale pentru femeile cu IMC ridicat, majoritatea sunt protocolul standard de agonist GnRH lung, protocolul de flare de micro-doză GnRH, protocolul antagonist GnRH, protocolul de plic. 27, 28, 29 combinate cu ET, care arată întotdeauna o scădere a rezultatelor sarcinii și a nașterilor vii. Prin urmare, am efectuat această analiză retrospectivă pentru a investiga rezultatele ovocitelor și sarcinii PPOS combinate cu strategia de tratament FET la femeile cu IMC ridicat.
Rezultate
Caracteristicile clinice și rezultatele FIV în cele două grupuri IMC sub tehnologia FET.
Tabelul 1 prezintă caracteristicile inițiale și rezultatele FIV utilizând tehnologia FET la pacienții din două grupuri IMC. Au existat 2.212 femei cu IMC normal și 320 de femei cu IMC ridicat (21,28 vs. 27,13; p 26, 27, 28, 29, FSH de bază (5,00 vs. 5,66, p 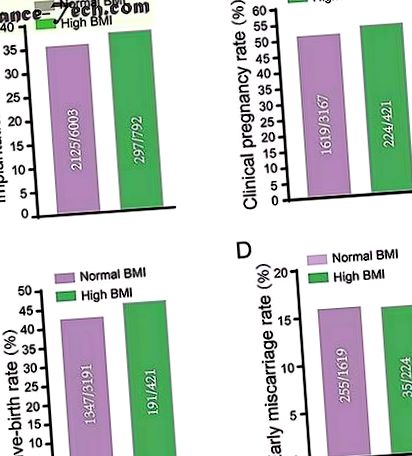
IMC normal și grupurile IMC ridicate nu au avut nicio diferență în rata de implantare ( LA ), rata clinică a sarcinii ( B ), rata natalității vii ( C ) și rata avortului spontan precoce ( D ) după FET. Datele brute au fost prezentate în cifre și analizate folosind testul Chi pătrat. Diferențele au fost considerate semnificative statistic atunci când valoarea p a fost mai mică de 0,05.
Imagine la dimensiune completă
Caracteristicile ciclurilor ovocitelor și rezultă în trei grupuri de stimulare ovariană în funcție de IMC-ul feminin.
În combinație cu tehnologia FET, am analizat rezultatele FIV ale celor trei grupuri diferite de stimulare ovariană: scurte convenționale, hMG + MPA (4 mg/zi) și hMG + MPA (10 mg/zi) separat la IMC normal. (18,5 - 24,9 kg/m 2) și indice de masă corporală ridicat (≥ 25 kg/m 2) grupuri de femei. Caracteristicile inițiale, profilurile hormonale și caracteristicile ciclului pacienților au fost prezentate în Tabelul 2. Mai întâi, am analizat rezultatele FIV ale acelorași femei cu IMC utilizând trei grupuri diferite de stimulare ovariană în Tabelul 2. Pentru În grupul de femei cu IMC normal, durata hMG a fost semnificativ mai lungă în grupul hMG + MPA (10 mg/zi) decât în grupul convențional scurt și hMG + MPA (4 mg/zi) (8,94 vs. 8,14 vs. 6,87, p
Există, de asemenea, limitări ale studiului nostru. În primul rând, acesta este un proiect de studiu retrospectiv și trebuie confirmat de un studiu controlat randomizat în viitor. În al doilea rând, grupul cu un IMC ridicat din studiul nostru a avut un singur grup (IMC ≥ 25), ceea ce este mai bun atunci când este împărțit mai precis dacă are suficiente cicluri, cum ar fi supraponderalitatea (IMC 25.0-29.0), obezitatea (IMC 30.0) - 49,9) și supraponderal (IMC> 50). În timp ce cele două grupuri hMG + MPA au îmbunătățit rezultatele clinice ale femeilor însărcinate din acest grup cu un IMC ridicat și utilizarea crescută a MPA, cele mai bune rezultate ale FIV. Aceste două grupuri hMG + MPA (4 sau 10 mg/zi) au efecte terapeutice consistente și dependente de doză în grupul cu IMC ridicat, contribuind la confirmarea efectului AMP la femeile cu IMC ridicat. În al treilea rând, nu am avut controlul ET în grupul cu IMC ridicat, ceea ce ne-ar putea ajuta să înțelegem îmbunătățirea rezultatelor sarcinii la femeile cu IMC ridicat, care inițial aveau un randament mai mic de ovocite decât femeile cu un IMC normal. . Cu toate acestea, multe cercetări anterioare arată că atunci când se utilizează ET, femeile cu un IMC ridicat ar urma această performanță adversă în timpul sarcinii, ca și în ovocit.
În concluzie, se poate presupune că protocolul de stimulare ovariană hMG + MPA (4 sau 10 mg/zi) combinat cu tehnologia FET ar putea fi un tratament eficient și acceptabil pentru femeile cu un IMC ridicat (≥25) comparativ cu protocolul convențional scurt, iar pentru femeile cu un IMC ridicat, hMG + MPA (10 mg/zi) este cea mai eficientă strategie de tratament în trei dintre ele. Rezultatele sugerează că protocolul hMG + MPA (4 sau 10 mg/zi) ar putea avea o eficiență mai bună, cu multe avantaje teoretice, precum FET ar putea permite ovarului și endometrului expus să se recupereze mai bine din stimularea ovariană, evitând efectul advers de niveluri ridicate de estradiol la implantare și MPA ar putea îmbunătăți parțial competența de dezvoltare a ovocitelor, în plus, MPA (10 mg) completează în mare măsură deficiența de progesteron la femeile cu IMC ridicat și are șanse mai mari de FIV cu succes.
Metode
Evaluarea indicelui de masă corporală
Greutatea și înălțimea au fost utilizate pentru a calcula IMC conform formulei standard: IMC = greutate/înălțime 2 (kg/m 2). Subiecții studiați corespunzători au fost împărțiți în două grupuri, pe baza IMC-ului pacienților și în conformitate cu standardele Organizației Mondiale a Sănătății: grup normal IMC (18,5 kg/m 2 ≤ IMC 2) și grup IMC ridicat (IMC ≥ 25 kg/m 2) 1 . Iar datele IMC s-au bazat pe informațiile despre înălțimea și greutatea măsurate în fișa medicală a fiecărui pacient.
Protocoale de stimulare ovariană
Protocol convențional de stimulare ovariană scurtă.
Un protocol standard pe termen scurt a fost folosit ca grup de control. Pacienților li s-au administrat 0,1 mg triptorelină zilnic din ciclul menstrual în ziua 2 (MC2) până la momentul administrării gonadotropinei corionice umane (HCG), iar hMG exogenă (150-225 UI) a fost administrată zilnic de la MC3. După 4 până la 5 zile de administrare a hMG, s-au efectuat o examinare cu ultrasunete transvaginală și teste de nivel hormonal seric, iar doza de hMG a fost ajustată optim în funcție de numărul și dimensiunea foliculilor în curs de dezvoltare. Etapa finală a maturării ovocitelor a fost indusă cu o injecție intramusculară de hCG (Lizhu Pharmaceutical Trading Co., Zhuhai, China) după ce foliculii dominanți au atins 18 mm în diametru. Dacă un pacient a avut mai mult de trei foliculi dominanți, s-au administrat 2.000 UI de hCG, în timp ce pentru pacienții cu cel mult trei foliculi dominanți, 5.000 UI de hCG au fost utilizate pentru activare. Recuperarea ovocitelor transvaginale ghidate cu ultrasunete a fost efectuată cu 34-36 h mai târziu.
Protocol PPOS
Evaluarea rezultatelor FIV
Pacienții au fost supuși tratamentului FIV, care a fost efectuat în conformitate cu procedurile de laborator de rutină în ziua extragerii ovocitelor, așa cum s-a descris anterior 55, 56. Pe scurt, Flushing Medium (Origio Medical Company, Danemarca) a fost utilizat pentru recuperarea ovocitelor, iar fluidul tubal uman (HTF; Irvine Scientific, CA, SUA) cu 10% Serum Supplement Serum (SSS; Irvine Scientific, CA, SUA) a fost utilizat ca mediul de colectare și inseminare a ovocitelor. Embrionii au fost crescuți într-un mediu de cultură continuu suplimentat cu 10% SSS (CSC; Irvine Scientific, CA, SUA).
Embrionii din ziua 3 a fiecărui ciclu de tratament FIV au fost examinați pentru numărul și regularitatea blastomerilor și gradul de fragmentare embrionară conform criteriilor Cummins 57. Embrionii de gradul I și II, care au fost considerați de înaltă calitate, au fost crioconservați; Embrionii de gradul III și IV au fost plasați în cultură extinsă până când au ajuns la stadiul de blastocist și numai blastocisturile morfologic bune au fost înghețate în ziua 5 sau în ziua 6. Procedura de vitrificare pentru înghețarea embrionilor în stadiu excizional și blastocistilor a fost efectuată folosind sistemul Cryotopcarrier (Kitazato Biopharma Co.) după cum sa raportat anterior 58. Pentru vitrificare, a fost utilizat un sistem vehicul criotop, cu un amestec de 15% (v/v) de etilen glicol (EG), 15% (v/v) de dimetilsulfoxid (DMSO) și zaharoză 0,5 M ca soluție crioprotectoare. Pentru dezgheț, s-au utilizat soluții de zaharoză 1, 0, 5 și 0 M pentru diluarea crioprotectoare pas cu pas.
Pregătirea endometrială și transferul embrionilor congelați
Pregătirea endometrială pentru fiecare ciclu de transfer a fost efectuată într-un ciclu natural, un ciclu ușor de stimulare sau o terapie de substituție hormonală, așa cum este descris în articolul nostru anterior 19, 21. Metoda noastră de sincronizare a embrionilor și endometrului în TEF a fost următoarea: pentru ciclurile naturale de TEF, creșterea foliculară a fost monitorizată cu hormoni serici și ultrasunete din ziua 10 a ciclului. Când grosimea endometrului a fost> 8 mm și diametrul foliculului dominant a fost> 16 mm. cu E2> 150 pg/ml și P 8 mm, Femoston (Solvay Pharmaceuticals BV) a fost început cu 8 mg/zi. Transferul embrionar a fost determinat în a treia zi după administrarea Femoston.
În toate ciclurile FET, unul sau doi embrioni decongelați au fost transferați în conformitate cu intenția pacientului. Odată realizată sarcina, suplimentarea exogenă cu estrogen și progesteron a fost continuată până la 8-10 săptămâni de gestație.
Analiza statistică
Expresii de recunoștință
Autorii mulțumesc femeilor infertile participante, precum și tuturor medicilor, asistenților medicali și personalului de laborator angajați în cadrul Departamentului de Reproducere Asistată al Spitalului al IX-lea al Poporului din Școala Universității Jiaotong din Shanghai. Mulțumesc WG ajută la revizuirea greșelilor de ortografie și de gramatică în limba engleză din manuscris. Această lucrare a fost susținută de granturi de la Fundația pentru Științe Naturale din China (număr de subvenție: 31400970 către LW, 15411953000, 81571397to YK) și Fundația pentru Științe Naturale din Shanghai (număr de subvenție: 15ZR1424900 la QL).
Comentarii
Prin trimiterea unui comentariu, sunteți de acord să respectați Termenii și regulamentele comunității noastre. Dacă găsiți ceva abuziv sau nu respectă termenii sau liniile directoare, marcați-l ca inadecvat.
- Cum să decongelați alimentele - Expiră alimentele congelate
- Cum să decongelați mâncarea în mod corect - Frozen Nicholas
- Cât durează alimentele congelate - Ecoviand de Brugarolas
- Cum să evitați efectul de revenire al dietelor; Nu mă voi îngrasa din nou
- Cum să evitați efectul de revenire cu Herbalife - Produse din plante
