Sindromul Cushing iatrogen la sugar la utilizarea prelungită a corticosteroizilor topici. Raport de caz
Javiera Hansen S. A
Patricia Lacourt R. B
O unitate de endocrinologie pediatrică, Departamentul de pediatrie. Facultatea de Medicină, Pontificia Universidad Católica de Chile. chili.
B Unitatea de Endocrinologie Pediatrică, Spitalul Serviciului de Pediatrie Dr. Sótero Del Río. chili.
Sindromul Cushing (CS) este o patologie endocrinologică datorată excesului de glucocorticoizi, dependentă sau independentă de hormonul corticotropinei (ACTH). Cauza principală este iatrogenă datorită utilizării excesive a glucocorticoizilor.
Pentru a demonstra asocierea dintre utilizarea prelungită a corticosteroizilor topici și dezvoltarea CS.
Copil mai în vârstă sănătos anterior, care a primit tratament cu corticosteroizi topici din cauza dermatitei seboreice. Datorită utilizării prelungite fără supraveghere, ea a dezvoltat sindromul Cushing caracterizat prin obezitate și rata de creștere compromisă. Utilizarea topică a fost suspendată și terapia a început cu o doză de înlocuire fiziologică în scădere, obținându-se îmbunătățirea clinică.
Corticosteroizii topici sunt utilizați pe scară largă în practica clinică pentru gestionarea patologiilor dermatologice. Acestea sunt disponibile în diferite prezentări și puncte forte. Principalii factori determinanți în acțiunea sa sunt: caracteristicile pielii, ingredientul activ al medicamentului, puterea și tehnica de aplicare, astfel încât efectele adverse să fie observate mai frecvent atunci când sunt utilizate pentru erupția pe scutec. Principalul efect advers al utilizării prelungite este dezvoltarea sindromului Cushing, care poate fi prevenit prin utilizarea supravegheată și reducerea progresivă.
Utilizarea rațională și atentă a corticosteroizilor topici este esențială pentru a profita de efectele benefice și pentru a evita apariția reacțiilor adverse.
Cuvinte cheie: Sindromul Cushing; glucocorticoizi topici; Efecte adverse; corticosteroizi
Sindromul Cushing este o tulburare endocrină sistemică, rezultatul unor niveluri anormal de ridicate de cortizol plasmatic. Incidența CS este imprecisă, în special la populația pediatrică. În general, cea mai frecventă cauză este iatrogenă, secundară administrării exogene excesive de glucocorticoizi. În ceea ce privește CS endogen, acest lucru poate apărea într-un mod dependent sau independent de creșterea secreției hormonului corticotropină (ACTH). În cadrul CS endogen, boala Cushing (adenom corticotrop) se prezintă în 60-70% din cazuri la cei cu vârsta peste 5 ani, iar producția ectopică de ACTH trebuie luată în considerare în diagnosticul diferențial și, în mod excepțional, producția ectopică a hormonului care eliberează corticotropina (CRH) . În ceea ce privește cazurile independente de ACTH, hipercortizolismul cronic inhibă secreția CRH și ACTH 2 prin feedback negativ. În acest grup, se sugerează evaluarea prezenței leziunii suprarenale unilaterale (adenom/carcinom) sau bilaterale (hiperplazie suprarenală macro sau micronodulară), în special la copiii cu vârsta sub 5 ani .
Utilizarea glucocorticoizilor topici este un instrument important în terapia dermatologică, datorită efectului său puternic antiinflamator și anti-proliferativ. Cu toate acestea, expunerea prelungită la corticosteroizi topici puternici poate produce efecte secundare secundare, cum ar fi manifestări cutanate (corticodermă), rata de creștere compromisă și suprimarea axei hipotalamo-hipofizo-suprarenale (HHA), 3 în special în absența unei supravegheri medicale adecvate.
Obiectivul acestei prezentări este de a demonstra asocierea dintre utilizarea prelungită a corticosteroizilor topici și dezvoltarea efectelor adverse (sindromul Cushing și viteza de creștere compromisă).
Pacient de sex masculin 1 an și 2 luni menționat pentru evaluare pentru statura scurtă, cu o rată de creștere compromisă de la vârsta de 6 luni. Primul copil al părinților non-consanguini, sarcină fiziologică controlată. Nou-născut pe termen de 40 de săptămâni potrivit pentru vârsta gestațională (RNT AEG) cu greutatea la naștere de 3.195 g și lungimea de 49 cm, fără patologie în perioada neonatală. Nu este descris niciun istoric morbid relevant.
În timpul primei evaluări la policlinica de endocrinologie pediatrică, s-a remarcat un fenotip caracteristic cushingoid, motiv pentru care s-a cerut direct utilizarea corticosteroizilor. Pe parcursul celei de-a treia luni de viață, pacientul a fost evaluat în CESFAM din cauza unei imagini a dermatitei prezente în scalp și zona perineală, fără antecedente de dermatită atopică subiacentă. Având în vedere acest lucru, a fost indicat un tratament topic cu cremă de acetat de hidrocortizon 1% asociat cu clotrimazol. Ulterior, pacientul a persistat cu simptome dermatologice, pentru care indicația a fost schimbată în cremă de dipropionat de betametazonă 0,05%. Datorită răspunsului clinic inițial bun la tratament, mama a menținut utilizarea cremei în fiecare moltă, ajungând la 10 luni de tratament continuu, fără o nouă reevaluare de către echipa de sănătate. Pacientul nu avea alte antecedente personale sau familiale relevante.
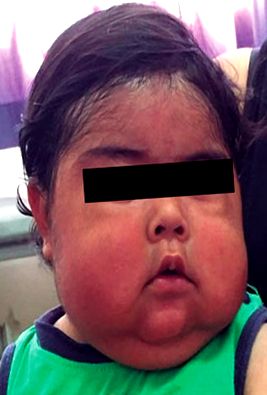
La momentul examinării fizice, pacientul prezenta un facies cushingoid cu ochi mici, gură de crap, obraji pufosi, grăsime bitemporală, hipertricoză și bărbie dublă (Figura 1). În cadrul evaluării sale antropometrice, o relație de înălțime/vârstă scăzută s-a remarcat cu un scor Z -4,26 și o relație de greutate/înălțime crescută cu un scor Z +2,93 (Figura 2). De asemenea, a fost investigată o creștere a tensiunii arteriale (TA 108/64 mmHg) luând în considerare percentila 95 (TA 102/54 mmHg) în funcție de sex, vârstă și înălțime 12. Restul examinării fără modificări semnificative, cu excepția persistenței unui eritem perineal ușor.
Figura 1 Primul consult ambulatoriu la vârsta de 1 an și 2 luni.
Figura 2 Curba de creștere cu deteriorarea inițială a ratei de creștere.
S-a ridicat suspiciunea sindromului Cushing iatrogen asociat cu obezitatea, hipertensiunea secundară în stadiul 1 (HT) și statura scurtă cu o rată de creștere slabă. În tratamentul inițial, a fost indicată suspendarea imediată a utilizării corticosteroizilor topici și tratamentul cu hidrocortizon a fost început oral (po) într-un interval de doze fiziologice ridicate (13,5 mg/m2/zi), educându-ne cu privire la ajustarea dozei la nivelul feței de patologie acută. În ceea ce privește gestionarea hipertensiunii arteriale, aceasta a fost administrată temporar cu hidralazină (1,5 mg/kg/zi sau fracționată la fiecare 8 ore) conform unei evaluări comune cu Nefrologie pediatrică. A fost solicitat un studiu biochimic inițial care să arate dislipidemie mixtă (colesterol total = 213 mg/dl și trigliceride = 153 mg/dl), funcția tiroidiană normală și vârsta osoasă întârziată (OS) (OS 6 luni pentru vârsta cronologică de 1 an 3 luni).
Pacientul a evoluat favorabil, cu o scădere progresivă a semnelor lui Cushing (figura 3) asociată cu o îmbunătățire a vitezei de creștere și o scădere progresivă în greutate. După finalizarea a 6 luni de tratament de substituție cu hidrocortizon oral (13 mg/m2/zi), a fost începută o scădere progresivă la 10 mg/m2/zi și s-a solicitat o măsurare a cortizolului bazal dimineața pentru a evalua posibila suspendare. Examenul a arătat un cortizol inițial de 7,3 ug/dL, pentru care s-a menținut o doză fiziologică (8 mg/m2/zi vo) și s-a solicitat un test ACTH cu microdoză (1 ug). Acest test a fost efectuat în cele din urmă după un an de tratament cu hidrocortizon, obținându-se ca rezultat un cor tisol pre-ACTH de 6,32 ug/dL și post-ACTH de 24,2 ug/dL (valoare de referință normală> 18 ug/dL). medicamentul a fost întrerupt.
Figura 3 Urmărire la 3 luni, 9 luni și 1 an de tratament cu cortizol oral.
Corticosteroizii topici sunt utilizați pe scară largă la populația pediatrică pentru gestionarea diferitelor patologii dermatologice. Acestea sunt disponibile în diferite prezentări, concentrații și potențe, 4 clasificându-le în grupele I-VII, în conformitate cu ultima caracteristică 5-7 (Tabelul 1) 10. Clobetasol-propionatul este cel mai puternic preparat asociat cu efecte secundare sistemice, dar orice corticosteroid aplicat în cantitate, durată și extensie suficientă le poate produce 5 .
Tabelul 1 Clasificarea corticosteroizilor topici în funcție de potență și vehicul. 6
Sunt descriși patru factori determinanți în aplicarea corticosteroizilor topici asociați cu un risc mai mare de apariție a efectelor secundare: piele (zona, extensia și indemnizația barierei), principiul activ al medicamentului (potența), vehiculul (forma de prezentare) și tehnica de aplicare (doză, frecvență și durata tratamentului) * 4, 9) .
La copii, se recomandă utilizarea corticosteroizilor topici cu cea mai mică potență posibilă (Tabelul 1), evaluând absorbția în funcție de prezentarea medicamentului, luând în considerare o absorbție mai mare în caz de cresitate mai mare (unguent> cremă> gel> loțiune> aerosoli> pulbere) . În ceea ce privește pielea, copiii sunt deosebit de sensibili la apariția reacțiilor adverse sistemice, datorită unei proporții mai mari de suprafață a pielii în raport cu greutatea lor (3, 5). Slăbiciunea pielii este asociată cu un grad mai ridicat de absorbție, în special în zone precum mucoasa, scrotul și pleoapele. Pe de altă parte, hidratarea pielii (baia anterioară), fricțiunea și ocluzia favorizează pătrunderea medicamentului. În acest context, principalii factori de risc pentru o absorbție mai mare sunt aplicarea pe pielea inflamată cu pierderea funcției de barieră și regiunea anatomică tratată pentru subțire în anumite regiuni indicate (membrana mucoasă și scrot) 4 .
O patologie caracterizată prin prezența ambilor factori este dermatita alergică de contact a scutecului. Această afecțiune trebuie diferențiată de erupția iritativă a scutecului (90% din cazuri), deoarece managementul se modifică semnificativ. În timp ce dermatita alergică poate fi tratată cu corticosteroizi topici și eventual inhibitori de calcineurină după evaluarea de către un specialist în dermatologie, derma titis iritant acordă prioritate restabilirii barierei cutanate prin măsuri generale, cum ar fi modificări frecvente ale scutecului și gestionarea eventualelor infecții fungice intercurente.
De obicei, indicația inițială a corticosteroizilor topici este justificată de beneficiile în managementul patologiei dermatologice 9 și, în plus, utilizarea adecvată a acestora produce efecte adverse ușoare, luând în considerare alegerea corticosteroizilor cu cea mai mică potență pentru a controla boala în mod adecvat. calea 5. Datorită celor de mai sus, echipa de sănătate trebuie să instruiască pacientul cu privire la utilizarea corectă a acestor medicamente și să-l educe cu privire la posibilele efecte adverse 5 .
Reacțiile adverse cauzate de utilizarea prelungită a corticosteroizilor topici includ suprimarea axei HHA și a sindromului Cushing cu o rată de creștere compromisă. Suprimarea axei H-H-A secundară corticosteroizilor exogeni este cea mai frecventă cauză a insuficienței suprarenale 8 și poate fi observată la până la 48% dintre pacienții tratați cu corticosteroizi puternici. Riscul de supresie crește în funcție de doza administrată și de durata tratamentului. De asemenea, perioada de recuperare a funcționalității axei suprarenale este proporțională cu timpul și intensitatea suprimării și poate dura câteva săptămâni sau luni pentru a se reactiva. În ceea ce privește CS, tipul clinic caracteristic este frecvent, în timp ce deteriorarea curbei de creștere este mai puțin descrisă. În caz de suspiciune clinică de CS, este necesară confirmarea prezenței hipercortizolismului într-un mod biochimic/hormonal. Apoi, după confirmare, se sugerează finalizarea unui studiu menit să stabilească cauza prin măsurarea ACTH plasmatic și evaluarea imagistică, după caz.
În contextul cazului prezentat și a frecvenței mai mari a cauzei iatrogene, un aspect fundamental al tratamentului este suspendarea corticosteroidului topic și suplimentarea cu hidrocortizon în doze fiziologice (9-12 mg/m 2/zi) în pa renteral. La fel, scăderea suplimentării trebuie efectuată progresiv și treptat pentru a permite reactivarea axei și funcționalitatea corectă a glandei suprarenale. În timpul urmăririi, un aspect important de luat în considerare este educarea și prevenirea împotriva patologiei intercurente acute, datorită unui risc ridicat de declanșare a unei crize suprarenale dacă doza nu este crescută temporar pentru a răspunde la stres.
În cele din urmă, trebuie remarcat faptul că se recomandă evaluarea funcției suprarenale adecvate prin măsurarea cortizolului inițial și/sau testul ACTH, acesta din urmă fiind considerat standardul de aur 4, 5 .
Pacientul nostru a prezentat semne clinice clasice ale excesului de corticosteroizi. În timpul copilăriei, modelul antropometric caracterizat prin creșterea în greutate asociată cu pierderea ratei de creștere ar trebui să ducă la suspiciunea sindromului Cushing în cadrul diagnosticului diferențial. Utilizarea rațională și atentă a corticosteroizilor topici are multiple beneficii terapeutice și poate evita apariția unor reacții adverse importante.
Protecția persoanelor și animalelor: Autorii declară că procedurile urmate au fost în conformitate cu standardele etice ale comitetului responsabil de experimentare umană și în conformitate cu Asociația Medicală Mondială și Declarația de la Helsinki.
Confidențialitatea datelor: Autorii declară că au respectat protocoalele centrului lor de lucru privind publicarea datelor pacienților.
Dreptul la confidențialitate și consimțământul informat: Autorii au obținut consimțământul informat al pacienților și/sau subiecților menționați în articol. Acest document este în posesia autorului corespunzător.
Conflict de interese: Autorii nu declară niciun conflict de interese.
1. Ashish T, Manjusha G, Pankaj P, Poorva G. Sindromul Cushing iatrogen indus de topic-steroizi în grupa de vârstă pediatrică: un raport de caz rar. Indian J Endocrinol Metab. 2013; 17 (Suppl1): S257-8. [Link-uri]
2. Kling MA, Roy A, Doran AR și colab. Lichidul cefalorahidian imunoreactiv, hormonul care eliberează corticotropina și secreția de adrenocorticotropină în boala Cushing și depresia majoră: implicații clinice potențiale. J Clin Endocrinol Metab 1991; 72: 260. [Link-uri]
3. Pranab S, Nilendu S, Nilanjan S, Prashant S. A Florid Case of Iatrogenic Cushing's Syndrome Induced by Topical steroid with Osteoporosis and Hypogonadism. Indian J Dermatol. 2015; 60 (4): 420. [Link-uri]
4. Dhar S, Seth J, Parikh D. Efecte secundare sistemice ale corticosteroizilor topici. Indian J Dermatol. 2014; 59 (5): 460-4. [Link-uri]
5. Casado-Verrier B, Sanz-Canalejas L, Gómez-Fernández C, Pagán B, López M, Casado-Jiménez M. Sindromul Iusrogenic Cushing din cauza corticosteroizilor topici la doi adulți. Med Cutan IberLat Am 2012; 40 (2): 58-61. [Link-uri]
6. Modelul OMS Informații de prescriere: medicamente utilizate în bolile pielii. 1999. [Link-uri]
7. Decani S, Federighi V, Baruzzi E, Sardella A, Lodi G. Sindromul Iatrogenic Cushing și terapia cu steroizi topici: serii de cazuri și revizuirea literaturii. J Tratare Dermatol. 2014; 25: 495-500. [Link-uri]
8. Messazos B, Zacharin M. Lecții din sindromul Cushing iatrogen la copii. J Paediatr Health Health. 2016; 52: 1106-10. [Link-uri]
9. Motes M, Suárez E, Velázquez P, Cedeño Y. Sindromul Cushing secundar tratamentului cu creme cu steroizi. Holguín Medical Scientific Mail 2008: 12 (5). [Link-uri]
10. Hengge UR, Ruzicka T, Schwartz RA, Cork MJ. Efecte adverse ale glucocorticosteroizilor topici. J Am Acad Dermatol. 2006; 54 (1): 1-18. [Link-uri]
11. Lacroix A, Feelders R, Stratakis C, sindromul Nieman L. Cushing. Lancet. 2015; 386 (9996): 913-27. [Link-uri]
12. Flynn JT, Kaelber DC, Baker-Smith CM și colab. Ghid de practică clinică pentru screening-ul și gestionarea tensiunii arteriale crescute la copii și adolescenți. Pediatrie. 2017; 140 (3): e20171904. [Link-uri]
Primit: 06 septembrie 2017; Aprobat: 24 ianuarie 2018
- Tratamentul (MRKH) și perspectivele sindromului Mayer-Rokitansky-Küster-Hauser; Știri-Medical
- Valoarea predictivă a sindromului metabolic în sarcină pentru dezvoltarea diabetului zaharat și
- Ce să mănânci pentru a ameliora sindromul premenstrual
- Tratamentul sindromului Rett și al complicațiilor sale - Salud al día
- Sindromul Alport Enciclopedia medicală MedlinePlus